
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
A. 纯净的液氨中,pN=7
B. 液氨达到电离平衡时c(NH3)=c(NH4+)+c(NH2-)
C. 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D. 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
【答案】C
【解析】A、纯净的液氨中,K=c(NH4+)·c(NH2-)=1.6×10-29,c(NH4+)=c(NH2-)=4.0×10-15,pN约为15,选项A错误;B、液氨的电离是微弱的,所以液氨电离达到平衡状态时,c(NH3)远大于电离的离子浓度,c(NH3)> c(NH4+)+c(NH2-),选项B错误;C、1 L溶解有0.001 mol NH4C1的液氨溶液,c(NH4+)= 0.001 mol/L,则pN=-lg c(NH4+)=3,选项C正确;D、1 L溶解有0.001 mol NaNH2的液氨溶液,c(NH2-)= 0.001 mol/L,则pN=-lg c(NH4+)=-lg![]() 11,选项D错误。答案选C。
11,选项D错误。答案选C。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】液氨气化后,分解产生的氢气可作为氢氧燃料电池的燃料。氨气分解反应的热化学方程式如下:2NH3(g) ![]() N2 (g) + 3H2(g) ΔH = + a kJ·mol-1 (a>0)。请回答下列问题:
N2 (g) + 3H2(g) ΔH = + a kJ·mol-1 (a>0)。请回答下列问题:
已知:2H2 (g) + O2 (g) =2H2O(l) ΔH1 = - b kJ·mol-1
NH3 (g) ![]() NH3(l) ΔH2 = - c kJ·mol-1
NH3(l) ΔH2 = - c kJ·mol-1
(1)氨气自发分解的反应条件为________(填“高温”、“ 低温”、“ 任何条件下”),4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(l) 的 ΔH3 =_____________kJ·mol-1。
(2)H2O的电子式为_____________,水能发生电离:2H2O(l) ![]() H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式____________________________________。
H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式____________________________________。
(3)液氨气化后,分解产生的氢气可作为氢氧燃料电池的燃料,在KOH电解质溶液中,电池负极的电极反应为__________________________________________,实验室中用氢氧燃料电池作为电源采用Pt电极对液氨进行电解可以得到H2和N2 ,若电解过程中阳极收集得到4.48L气体(标况),则转移的电子的数目是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示: 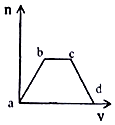
(1)ab段发生的离子反应方程式为 .
(2)bc段依次发生两个离子反应,首先是 , 其次是 .
(3)cd段发生的离子反应方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题。
(1)在同温、同压下,实验测得CO,N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 . 若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为 .
(2)相同条件下,某Cl2与O2混合气体100mL恰好与150mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为 , 混合气体的平均相对分子质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列递变情况中,正确的是
A. Na、Mg、Al原子的最外层电子数依次减少
B. Si、P、S元素的最高正价依次降低
C. C、N、O的原子半径依次减小
D. Li、Na、K的金属性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是
2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是
A.10到15秒内c(NH3) 增加量等于0.25mol L—1
B.化学反应速率关系是:3υ正(H2)= 2υ正(NH3)
C.达平衡后,分离出少量NH3,V正 增大
D.该反应的逆反应的活化能不小于92.2kJmol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com