
����Ŀ��Һ�������ֽ��������������Ϊ����ȼ�ϵ�ص�ȼ�ϡ������ֽⷴӦ���Ȼ�ѧ����ʽ���£�2NH3(g) ![]() N2 (g) + 3H2(g) ��H = + a kJ��mol-1 (a��0)����ش�����������
N2 (g) + 3H2(g) ��H = + a kJ��mol-1 (a��0)����ش�����������
��֪��2H2 (g) + O2 (g) =2H2O(l) ��H1 = - b kJ��mol-1
NH3 (g) ![]() NH3(l) ��H2 = - c kJ��mol-1
NH3(l) ��H2 = - c kJ��mol-1
��1�������Է��ֽ�ķ�Ӧ����Ϊ________���������������� ���������� �κ�������������4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(l) �� ��H3 =_____________kJ��mol-1��
��2��H2O�ĵ���ʽΪ_____________��ˮ�ܷ������룺2H2O(l) ![]() H3O++OH-��Һ��Ҳ�ܷ������Ƶĵ��롣��д��Һ���ĵ��뷽��ʽ____________________________________��
H3O++OH-��Һ��Ҳ�ܷ������Ƶĵ��롣��д��Һ���ĵ��뷽��ʽ____________________________________��
��3��Һ�������ֽ��������������Ϊ����ȼ�ϵ�ص�ȼ��,��KOH�������Һ�У���ظ����ĵ缫��ӦΪ__________________________________________��ʵ������������ȼ�ϵ����Ϊ��Դ����Pt�缫��Һ�����е����Եõ�H2��N2 �����������������ռ��õ�4.48L���壨���������ת�Ƶĵ��ӵ���Ŀ��_________________��
���𰸡� ���� 2a-3b+4c ![]() 2NH3(l)
2NH3(l) ![]() NH4++NH2�� H2-2e��+2OH��===2H2O 1.2NA��7.2��1023
NH4++NH2�� H2-2e��+2OH��===2H2O 1.2NA��7.2��1023
����������1�������ֽ������ȵ��������ķ�Ӧ��������G=��H��T����S��0�����ж��ڸ����¿����Է����У�
��֪����2NH3��g��N2��g��+3H2��g����H=+a kJmol-1
��2H2��g��+O2��g����2H2O��l����H=-b kJmol-1
��NH3��g��NH3��l����H=-c kJmol-1
���ݸ�˹���ɿ�֪���١�2+�ڡ�3-�ۡ�4�ɵã�4NH3��l��+3O2��g����2N2��g��+6H2O��l����H=��2a-3b+4c��kJ/mol��
��2��H2O�ǹ��ۻ��������ʽΪ![]() ��Һ��������ˮ�ĵ��룬��֪ˮ�ĵ��뷽��ʽ��дΪ2H2OH3O++OH������Һ���ĵ��뷽��ʽΪ2NH3NH4++NH2������3�������ڸ�������ʧȥ���ӵ�������Ӧ����KOH�������Һ�У���ظ����ĵ缫��ӦΪH2-2e��+2OH����2H2O��ʵ������Pt�缫��Һ�����е����Եõ�H2��N2���������ռ���������ΪN2�������4.48L���������ʵ���Ϊ0.2mol�������ʱ��Ԫ�صļ�̬��-3�۱�Ϊ0�ۣ��ʵ�����0.2mol����ʱת��0.2mol��6=1.2mol���ӣ���1.2NA��������
��Һ��������ˮ�ĵ��룬��֪ˮ�ĵ��뷽��ʽ��дΪ2H2OH3O++OH������Һ���ĵ��뷽��ʽΪ2NH3NH4++NH2������3�������ڸ�������ʧȥ���ӵ�������Ӧ����KOH�������Һ�У���ظ����ĵ缫��ӦΪH2-2e��+2OH����2H2O��ʵ������Pt�缫��Һ�����е����Եõ�H2��N2���������ռ���������ΪN2�������4.48L���������ʵ���Ϊ0.2mol�������ʱ��Ԫ�صļ�̬��-3�۱�Ϊ0�ۣ��ʵ�����0.2mol����ʱת��0.2mol��6=1.2mol���ӣ���1.2NA��������


 ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڰ����ӵ�������NA����˵������ȷ������ ��
A. ���³�ѹ�µ�33. 6L������27g����ַ�Ӧ��ת�Ƶ�����Ϊ3NA
B. 4.6��Na��ԭ�ӱ�ΪNa+ʱ����ʧȥ�ĵ�����Ϊ0.2NA
C. 0.1mol Fe��������ˮ������Ӧ���ɵ�H2������Ϊ0.1NA
D. ��CO��O2��ɵĻ�����й���NA�����ӣ����е���ԭ����Ϊ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ����Ļ����Һ200 mL��ƽ���ֳ����ݡ�������һ��������ͭ�ۣ�������ܽ�9.6 g������һ�����������ۣ�������������������������ӵı仯����ͼ��ʾ(��֪����ֻ����ԭΪNO����)�����з��������������

A. ԭ�������HNO3�����ʵ���Ϊ0.1 mol
B. OA�β�������NO��AB�εķ�ӦΪFe��2Fe3�� == 3Fe2����BC�β�������
C. �ڶ�����Һ����������ΪFeSO4
D. H2SO4Ũ��Ϊ2.5 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾa��b��c��d�ֱ��Ǽ��ֳ���©�����ϲ���A��B��C��D��ʵ�ʲ����и�©�����²����������е�ʾ��ͼ����ָ��A��B��C��D�ֱ���a��b��c��d��ƥ�����ϼ�����Ϻ�װ����ʵ���е�Ӧ�ã����磺C��a��ϣ�������ȡ���壮��A����ϣ����� �� ��B����ϣ����� ��
��B����ϣ����� �� ��D����ϣ����� �� 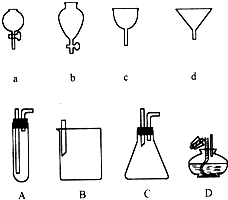
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2NO2(g)N2O4(g)������ӦΪ���ȷ�Ӧ���ﵽƽ��������¶ȣ�����������ɫ
A.����B.��dzC.����D.���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�����ӷ���ʽ��
��1��ʵ�����Ʊ�������̼����
��2������������ϡ���ᷴӦ
��3��ʳ��ˮ����������Һ��Ӧ
��4������������Һ������ķ�Ӧ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���NO��������ȷ���� ( )
A. NO������ˮ�����Կ����ſ������ռ�
B. NO��һ���д̼�����ζ�ĺ���ɫ����
C. ���³�ѹ�£�����������Ԫ�ص�NO��CO��������
D. NO����ͨ�����Ϸ�Ӧ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڡ������ᴿ�����ܽ⡢���ˡ������ᾧ��ʵ�鲽���У�ʹ�ô�������������( )
A. �ձ� B. ������ƽ C. ������ D. ©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���봿ˮ�ĵ������ƣ�Һ����Ҳ���������ĵ��룺2NH3![]() NH4����NH2��.ij�¶��£�Һ�������ӻ�����K=c(NH4+)��c(NH2-)=1.6��10-29�����ö���pHһ�����涨pN=-lg c(NH4+)�����ڸ��¶��£�����������ȷ����
NH4����NH2��.ij�¶��£�Һ�������ӻ�����K=c(NH4+)��c(NH2-)=1.6��10-29�����ö���pHһ�����涨pN=-lg c(NH4+)�����ڸ��¶��£�����������ȷ����
A. ������Һ���У�pN=7
B. Һ���ﵽ����ƽ��ʱc(NH3)��c(NH4��)+c(NH2��)
C. 1 L�ܽ���0.001 mol NH4C1��Һ����Һ����pN=3
D. 1 L�ܽ���0.001 mol NaNH2��Һ����Һ����pN=11
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com