
【题目】日常生活和工业生产中常用到漂白剂,下列物质的溶液具有漂白作用的是
A. CuSO4 B. CaCl2 C. Na2SO4 D. Ca(ClO)2
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
【题目】200mL 0.3molL﹣1的K2SO4溶液和100mL 0.2molL﹣1的Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO ![]() 的物质的量浓度为( )
的物质的量浓度为( )
A.0.3 molL﹣1
B.0.4 molL﹣1
C.0.45 molL﹣1
D.0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对电解原理进行实验探究。
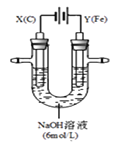
请回答:
用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42—)在溶液中呈紫红色。
(1)电解过程中,X极区溶液的pH________(填“增大”、“减小”或“不变”);
(2)电解过程中,Y极发生的电极反应为Fe-6e—+8OH—═FeO42—+4H2O 和 4OH——4e—═2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常用于混合物的分离和提纯的装置示意图,请回答: 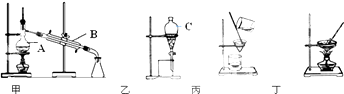
(1)图中仪器A、B、C的名称依次是、、 .
某研究性学习小组设计并进行以下实验从海带中提取碘:![]()
(2)灼烧海带时,除需要泥三角、三脚架、坩埚外,还需要用到的实验仪器是(填字母).
A.烧杯
B.蒸发皿
C.酒精灯
D.坩埚钳
(3)步骤③的操作名称是 , 也可以用汽油做实验,理由是 .
(4)步骤④的目的是从含碘的苯溶液中分离出单质碘,同时回收苯,选择上述装置图(填图的序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、、以及等质量的两片滤纸.
(2)计算.配制该溶液需取NaCl晶体g.
(3)称量.①天平调平之后,应将天平的游码调至某个位置,请在图1中用一根竖线标出游码左边缘所处的位置: 
②称量过程中NaCl晶体应放于天平的(填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀. 将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、、 .
(7)在配制过程中,某学生观察定容时液面情况如图2所示,所配溶液的浓度会(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液中:Na+、K+、Br-、CO32-
B. 0.1 mol/LCa(ClO)2溶液中:Fe2+、A13+、I-、SO42-
C. 0.1 mol/L Fe2(SO4)3溶液中:NH4+、Cu2+、NO3-、Cl-
D.  -13 mol/L的溶液中:Ca2+、NH4+、CH3COO-、HCO3-
-13 mol/L的溶液中:Ca2+、NH4+、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量是指单位物质的量的物质所具有的质量.
(1)已知O的相对原子质量为16,则O3的摩尔质量为 .
(2)48gN2H4的物质的量为 , 所含氢原子数目为 .
(3)标准状况下,相同体积的CH4和SO2气体的质量比为;相同质量的CH4和SO2分子个数比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
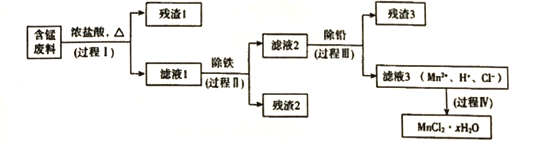
资料a: Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH见下表(金属离子的起始浓度为0.1 mol·L-1)
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
(1)过程I的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是__________________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入黄色K3[Fe(CN)6](铁氰化钾)溶液,无明显变化:另取少量滤液1于试管中,___________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:i.2Fe2++Cl2=2Fe3++2Cl-
ii.4Fe2++O2+4H+=4Fe3++2H2O iii.……
写出iii的离子方程式:___________________________。
(2)过程II的目的是除铁,有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ii.焙烧法:将滤液1浓缩得到的固体于290°C焙烧,冷却,取焙烧物……
己知:焙烧中发生的主要反应2FeCl3+3O2=2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在 _______________之间。
②补全ii中的操作:____________________。
③两种方法比较,氨水法除铁的缺点是_________________________________________。
(3)过程III的目的是除铅。加入的试剂是______________________。
(4)过程IV所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com