
【题目】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验
(1)配制50mL 1.0mol·L-1 的FeCl3 溶液,测其pH约为0.7,即c(H+)=0.2mol·L-1。
①用化学用语解释FeCl3溶液呈酸性的原因:__________________。
②下列实验方案中,能使FeCl3溶液pH升高的是___________(填字母序号)。
a. 加水稀释 b. 加入FeCl3固体 c. 滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50mL 1.0mol·L-1 的FeCl3 溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn+2NaOH=Na2ZnO2+H2↑
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:_________________________。 ②用离子方程式解释反应后溶液为浅绿色的原因:______________________________。
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是______________。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是________________。
【答案】 Fe3++3H2O![]() Fe(OH)3+3H+ acd Fe3++3H2O
Fe(OH)3+3H+ acd Fe3++3H2O![]() Fe(OH)3+3H+,Zn消耗H+,同时放出热量,都会促进Fe3++3H2O
Fe(OH)3+3H+,Zn消耗H+,同时放出热量,都会促进Fe3++3H2O![]() Fe(OH)3+3H+正向移动,出现红褐色Fe(OH)3 沉淀 2Fe3++Zn=2Fe2++Zn2+ Fe和Zn iii中,若存在Fe3O4,稀盐酸与Fe3O4反应产生的Fe3+,可与Fe或者Zn继续反应生成Fe2+,导致在iv中检测不到Fe3+,与没有Fe3O4得到的iv中现象相同
Fe(OH)3+3H+正向移动,出现红褐色Fe(OH)3 沉淀 2Fe3++Zn=2Fe2++Zn2+ Fe和Zn iii中,若存在Fe3O4,稀盐酸与Fe3O4反应产生的Fe3+,可与Fe或者Zn继续反应生成Fe2+,导致在iv中检测不到Fe3+,与没有Fe3O4得到的iv中现象相同
【解析】(1)①FeCl3溶液呈酸性的原因是Fe3++3H2O ![]() Fe(OH)3+3H+,故答案为:Fe3++3H2O
Fe(OH)3+3H+,故答案为:Fe3++3H2O ![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
②a能使FeCl3溶液pH升高是促进水解逆向进行,Fe3++3H2O ![]() Fe(OH)3+3H+。a.加水稀释促进水解平衡正向进行,溶液pH增大,故a正确;b.加入FeCl3固体溶解后平衡正向进行,溶液pH减小,故b错误;c.滴加浓KSCN溶液,结合铁离子生成硫氰酸铁,水解平衡逆向进行,溶液pH增大,故c正确;d.加入NaHCO3固体溶解后碳酸氢根离子结合氢离子促进平衡正向进行,溶液pH增大,故d正确;故答案为:acd;
Fe(OH)3+3H+。a.加水稀释促进水解平衡正向进行,溶液pH增大,故a正确;b.加入FeCl3固体溶解后平衡正向进行,溶液pH减小,故b错误;c.滴加浓KSCN溶液,结合铁离子生成硫氰酸铁,水解平衡逆向进行,溶液pH增大,故c正确;d.加入NaHCO3固体溶解后碳酸氢根离子结合氢离子促进平衡正向进行,溶液pH增大,故d正确;故答案为:acd;
(2)向反应瓶中加入6.5g锌粉物质的量=![]() =0.1mol,然后加入50mL 1.0molL-1的FeCl3溶液,溶液中铁离子物质的量=0.050L×1.0mol/L=0.05mol,2Fe3++Zn=2Fe2++Zn2+,根据反应定量关系可知锌过量,搅拌溶液温度迅速上升,说明发生的反应为放热反应,稍后出现红褐色沉淀为氢氧化铁沉淀,同时出现少量气泡,收集检验反应过程中产生的气体,集气管口靠近火焰,有爆鸣声证明为氢气,说明锌和铁离子水解生成的酸反应生成氢气,促进水解平衡正向进行生成氢氧化铁沉淀;反应一段时间后静置,上层溶液为浅绿色为氯化亚铁溶液,反应瓶底部有黑色固体,可能为过量的锌和氯化亚铁反应生成的金属铁,Zn的性质与Al相似,能发生反应:Zn+2NaOH═Na2ZnO2+H2↑。
=0.1mol,然后加入50mL 1.0molL-1的FeCl3溶液,溶液中铁离子物质的量=0.050L×1.0mol/L=0.05mol,2Fe3++Zn=2Fe2++Zn2+,根据反应定量关系可知锌过量,搅拌溶液温度迅速上升,说明发生的反应为放热反应,稍后出现红褐色沉淀为氢氧化铁沉淀,同时出现少量气泡,收集检验反应过程中产生的气体,集气管口靠近火焰,有爆鸣声证明为氢气,说明锌和铁离子水解生成的酸反应生成氢气,促进水解平衡正向进行生成氢氧化铁沉淀;反应一段时间后静置,上层溶液为浅绿色为氯化亚铁溶液,反应瓶底部有黑色固体,可能为过量的锌和氯化亚铁反应生成的金属铁,Zn的性质与Al相似,能发生反应:Zn+2NaOH═Na2ZnO2+H2↑。
①根据上述分析,出现红褐色沉淀的原因是Fe3++3H2O![]() Fe(OH)3+3H+,Zn消耗H+,同时放出热量,都会促进Fe3++3H2O
Fe(OH)3+3H+,Zn消耗H+,同时放出热量,都会促进Fe3++3H2O![]() Fe(OH)3+3H+正向移动,出现红褐色Fe(OH)3 沉淀,故答案为:Fe3++3H2O
Fe(OH)3+3H+正向移动,出现红褐色Fe(OH)3 沉淀,故答案为:Fe3++3H2O![]() Fe(OH)3+3H+,Zn消耗H+,同时放出热量,都会促进Fe3++3H2O
Fe(OH)3+3H+,Zn消耗H+,同时放出热量,都会促进Fe3++3H2O![]() Fe(OH)3+3H+正向移动,出现红褐色Fe(OH)3 沉淀;
Fe(OH)3+3H+正向移动,出现红褐色Fe(OH)3 沉淀;
②反应后溶液为浅绿色的原因是铁离子和锌反应生成亚铁离子和锌离子的溶液,反应的离子方程式为:2Fe3++Zn═2Fe2++Zn2+,故答案为:2Fe3++Zn═2Fe++Zn2+;
③i.黑色固体可以被磁铁吸引说明含铁;ii.向黑色固体中加入足量的NaOH溶液,产生气泡,证明含有锌;iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡,证明为金属锌;iv.向iii反应后的溶液中滴加KSCN溶液,无变化说明为铁离子。
a.分析可知黑色固体中一定含有的物质是Fe和Zn,故答案为:Fe和Zn;
b.上述实验无法确定黑色固体中是否含有Fe3O4,理由是iii中,若存在Fe3O4,稀盐酸与Fe3O4反应产生的Fe3+可与Fe继续反应生成Fe2+,导致在iv中检测不到Fe3+,与没有Fe3O4得到的iv中现象相同,故答案为:iii中,若存在Fe3O4,稀盐酸与Fe3O4反应产生的Fe3+可与Fe继续反应生成Fe2+,导致在iv中检测不到Fe3+,与没有Fe3O4得到的iv中现象相同。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙醇的沸点比含相同碳原子的烷烃的沸点高的主要原因是( )
A.乙醇的分子量比含相同碳原子的烷烃的分子量大
B.乙醇分子之间易形成氢键
C.碳原子与氢原子的结合程度没碳原子与氧原子的结合程度大
D.乙醇是液体,而乙烷是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图. 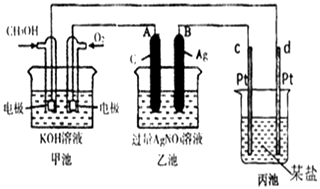
(1)请回答图中甲池是装置,其中OH﹣移向极(填“正”或“负”)
(2)写出通入CH3OH的电极反应式是
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为极(填“A”或“B”),并写出此电极反应的电极反应式 .
(4)乙池中反应的离子方程式为 .
(5)当乙池中B(Ag)极的质量增加2.70g时,乙池的pH是(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.80g某金属,则丙中的某盐溶液可能是(填序号)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.该原子的摩尔质量是aNA
B.Wg该原子的物质的量一定是 ![]() mol
mol
C.Wg该原子中含有 ![]() 个该原子
个该原子
D.由已知信息可得:NA= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡是无色液体,熔点﹣33℃,沸点114℃.氯气与金属锡在加热时反应可以用来制备SnCl4 , SnCl4极易水解,在潮湿的空气中发烟.实验室可以通过图装置制备少量SnCl4 (夹持装置略). 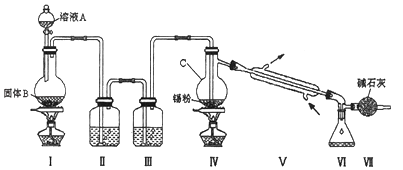
(1)仪器C的名称为:;
(2)装置Ⅰ中发生反应的离子方程式为:;
(3)装置Ⅱ中的最佳试剂为 , 装置Ⅶ的作用为;
(4)若装置连接顺序为Ⅰ﹣Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4外,还会生成的含锡的化合物的化学式为 .
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为;
(6)若Ⅳ中用去锡粉11.9g,反应后,Ⅵ中锥形瓶里收集到23.8g SnCl4 , 则SnCl4的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将 100g10%的盐酸加热蒸发,得到 50 g溶液,其浓度为20%
B.把3mol/L的硫酸与等体积的水混合,所得溶液的浓度大于1.5 mol/L
C.把200mL3mol/L的BaCl2溶液跟100mL3mol/L的KCl溶液混合后,溶液中的c(Cl﹣)仍然是3 mol/L
D.已知某温度下KNO3的溶解度是 31.6 g/100 g水,在该温度下将 20 g的KNO3溶于 50 g的水中,所得溶液的质量分数是28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2Cl6晶体在常温下就会“升华”,蒸气冷却可得到晶体ICl3。ICl3遇水会产生大量的腐蚀性白色烟雾,有强烈的催泪性。若生成物之一是HCl,则另一种是( )
A.HIO3B.HIO2C.HIOD.ICl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下几种物质①熔融氯化钠 ②液态氯化氢 ③Cu ④蔗糖 ⑤KAl(SO4)2⑥NaHCO3溶液,填空回答:(填序号)
(1)以上物质中属于电解质的是; 属于非电解质的是;能导电的是 .
(2)写出⑤的电离方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由锌,铁,镁,铝四种金属中的两种组成的混合物20g,跟足量的盐酸反应,反应后生成的氢气为22.4L,(标准状况),则该混合物中,一定含有的金属是( )
A.锌
B.铁
C.镁
D.铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com