
【题目】由锌,铁,镁,铝四种金属中的两种组成的混合物20g,跟足量的盐酸反应,反应后生成的氢气为22.4L,(标准状况),则该混合物中,一定含有的金属是( )
A.锌
B.铁
C.镁
D.铝
【答案】D
【解析】解:标况下22.4L氢气的物质的量为: ![]() =1mol,故20g金属提供的电子为1mol×2=2mol,则提供1mol电子需要金属的质量为10g, A.Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol×
=1mol,故20g金属提供的电子为1mol×2=2mol,则提供1mol电子需要金属的质量为10g, A.Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol× ![]() =32.5g;
=32.5g;
B.Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol× ![]() =28g;
=28g;
C.Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol× ![]() =12g;
=12g;
D.Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol× ![]() =9g;
=9g;
提供1mol电子,只有Al的质量小于10g,其它金属的质量都大于10g,故金属混合物中一定有Al,
故选D.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验
(1)配制50mL 1.0mol·L-1 的FeCl3 溶液,测其pH约为0.7,即c(H+)=0.2mol·L-1。
①用化学用语解释FeCl3溶液呈酸性的原因:__________________。
②下列实验方案中,能使FeCl3溶液pH升高的是___________(填字母序号)。
a. 加水稀释 b. 加入FeCl3固体 c. 滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50mL 1.0mol·L-1 的FeCl3 溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn+2NaOH=Na2ZnO2+H2↑
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:_________________________。 ②用离子方程式解释反应后溶液为浅绿色的原因:______________________________。
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是______________。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA
B.48g O3 和O2混合气体所含的原子数目为3NA
C.1mol氦气所含的电子数目为4NA
D.2.7g金属铝变成铝离子时失去的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用大理石和盐酸制备CO2。下列措施可使反应速率加快的是( )
A. 降低反应温度 B. 延长反应时间 C. 粉碎大理石 D. 加水稀释盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为3.00mol物质A,B混合于5L容器中,发生如下反应:3A+B2C,在反应过程中C的物质的量分数随温度变化如图所示: 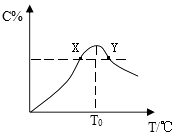
(1)T0对应的反应速率v(正)v(逆)(用“=”、“>”或“<”表示,下同);
(2)此反应的正反应为热;(填“放”或“吸”)
(3)X,Y两点A物质正反应速率的大小关系是YX;
(4)温度T<T0时,C%逐渐增大的原因是:;
(5)若Y点的C的物质的量分数为25%,则参加反应的A物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置.将A、B、C、D 填入适当的空格中.
(1)分离植物油和水;
(2)除去粗盐中的泥沙;
(3)与海水晒盐原理相似的是;
(4)用四氯化碳碘水中提取碘;
(5)分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp[Fe(OH)3]=2.6×10-39,回答下列问题:
(1)FeCl3溶液可用做净水剂,其净水原理为(用离子方程式表示):______________________。
(2)某酸性MgCl2溶液中含有少量FeCl3,为得到纯净的MgCl2溶液,可加入___________调节溶液的pH=4,使溶液中的Fe3+变为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________________。
(3)由FeCl3·6H2O晶体得到纯的无水FeCl3的合理方法是:______________________________。
(4)草酸亚铁是制备高纯度活性铁粉的原料,其样品纯度测定步骤如下:准确称取草酸亚铁(FeC2O4)样品wg,将其研成粉末后溶于适量的稀硫酸中(假设杂质不反应)配成250omL溶液。准确量取20mL该溶液于锥形瓶中,用cmol/L的K2Cr2O7酸性溶液(用稀硫酸酸化)滴定至终点,消耗滴定液VmL(还原产物为Cr3+,氧化产物为Fe3+和CO2)。
①滴定时反应的离子方程式为____________________________________。
②该草酸亚铁样品的纯度为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组比值为1∶2的是( )
A. 0.1mol/L与0.2mol/L醋酸溶液,c(H+)之比
B. 0.lmol/LNa2CO3溶液,c(CO32-)与c(Na+)之比
C. pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D. pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中如果反应前后元素化合价发生改变,就一定有转移,这类反应就属于反应.如果元素化合价升高,表明该元素原子电子,含该元素的物质发生反应,这种物质是剂;元素化合价降低,表明该元素的原子电子,含该元素的物质发生反应,这种物质是剂.在中学化学中常用作氧化剂的物质(任写一种)常用作还原剂的物质有(任写一种).硫在氧气中燃烧的化学方程式;其中,硫是剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com