
【题目】下列叙述正确的是 ( )
A. 甲苯既可使溴的四氯化碳溶液因发生反应而褪色,也可使酸性高锰酸钾溶液褪色
B. H3C  OH的消去产物有两种
OH的消去产物有两种
C. 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2===CH—COOCH3
D. 可用溴水鉴别乙醛、四氯化碳、苯和乙酸
科目:高中化学 来源: 题型:
【题目】用“>”“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
(2)相同条件下,2 mol氢原子所具有的能量______1 mol氢分子所具有的能量。
(3)已知常温下红磷比白磷稳定,比较下列反应中(反应条件均为点燃)ΔH的大小:ΔH1______ ΔH2。
①P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1,
②4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2。
(4)已知:101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则碳的燃烧热数值________110.5 kJ·mol-1。
(5)已知:稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量________57.3 kJ;稀硫酸和稀氢氧化钡溶液中和生成1 mol 水放出的热量_______________57.3 kJ。
(6)已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:
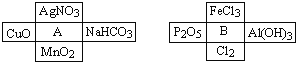
请回答下列问题:
(1)A溶液与B溶液反应的离子方程式 ______ .
(2)若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为 ______
(3)在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是: ______ .
Ⅱ、在Na+浓度为0.6mol/L的某澄清溶液中,还可能含有表中的若干种离子:
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SO42-、SiO32- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
试回答下列问题:
(1)实验I中生成沉淀的离子方程式为______。
(2)实验Ⅱ中判断沉淀是否洗涤干净的操作为:______。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,判断K+______ 一定存在(填“是”或“否”),若存在,其最小浓度为______。(若不存在,此空不需填写)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na2CO3和NaHCO3的混合物加热,充分反应至固体质量不再减少,生成CO2气体的体积为2.24L,反应后的固体残渣与100mLHCl溶液恰好完全反应,又生成CO2气体4.48L(气体体积均在标准状况下测定)。试求:
(1)原混合物中Na2CO3和NaHCO3的物质的量各为多少_________?
(2)所用HCl溶液的物质的量浓度_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列各物质的制取方法填写在后面的短线中。
(1)用煤制取煤焦油。__________
(2)用煤焦油制取二甲苯。__________
(3)用石油制汽油。__________
(4)用煤油制乙烯。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12.8g铜片加入到100ml一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400ml、2mol/L NaOH溶液,能使溶液中的Cu2+恰好完全沉淀。下列说法不正确的是
A. 反应后溶液中剩余NO3-的物质的量为0.4mol
B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol
D. 混合气体中NO和NO2的体积之比为1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中以Zn、CrCl3溶液、CH3COONa溶液和盐酸为主要原料制备醋酸亚铬晶体,其装置如下图所示。仪器2中已预先加入锌粒,仪器3中已加人CH3COONa溶液。

资料卡:
①醋酸亚铬晶体[[Cr(CH3COO)2]22H2O;深红色晶体,不溶于冷水,是常用的氧气吸收剂。
②Cr2+不稳定,极易被氧气氧化,不与锌反应。
③部分相关的化学反应:
2CrCl3+Zn═2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]22H2O
④Ksp[Cr(OH)3]=6.3×10-31,![]() ≈4,lg2≈0.3
≈4,lg2≈0.3
回答下列问题:
(1)仪器1的名称是_______________。
(2)实验时先往仪器2中加盐酸,一段时间后再加CrCl3溶液,目的是_________。
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门_______,打开阀门_______。
(4)本实验中锌粒要过量,其原因除了使产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是_______________。
(5)铬的离子会污染水资源。常温下要除去上述实验中多余的Cr2+,①先向废液中通入足量的______,将Cr2+转变为Cr3+,反应的离子方程式为_______;②再加入碱液,调节pH至少为_____才能使Cr3+沉淀完全[c(Cr3+)<10-5mol/L]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图:
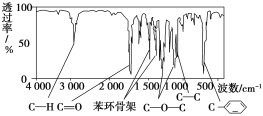
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的分子式为________。
(2)A的结构简式为_______________________________________________(写一种即可)。
(3)A的芳香化合物类同分异构体有多种,其中分子中不含甲基的芳香酸为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com