
ЁОЬтФПЁП
ЃЈ1ЃЉЁАЫйСІЗЦЁБ(жївЊГЩЗжЃКчњчъЫсбЧЬњЃЌГЪАЕЛЦЩЋ)ЪЧЪаГЁЩЯвЛжжГЃМћЕФВЙЬњвЉЮяЁЃФГЭЌбЇЮЊСЫМьВтЁАЫйСІЗЦЁБвЉЦЌжаFe2ЃЋЕФДцдкЃЌЩшМЦВЂНјааСЫШчЯТЪЕбщЃК

ЂйЪЕбщЪвдкХфжЦЯЁСђЫсШмвКЪБЃЌЯТСаВйзїПЩдьГЩХфжЦНсЙћЦЋИпЕФЪЧ________________ЁЃ
AЃЎВЩгУбіЪгЕФЗНЪНСПШЁХЈСђЫс |
BЃЎШнСПЦПдкЪЙгУЧАЮДИЩдяЃЌРяУцгаЩйСПеєСѓЫЎ |
CЃЎЖЈШнЪБЃЌИЉЪгШнСПЦППЬЖШЯп |
DЃЎЖЈШнвЁдШКѓЗЂЯжвКУцЕЭгкШнСПЦПЕФПЬЖШЯпЃЌдйМгЫЎжСПЬЖШ |
ЂкЁАЗўгУЮЌЩњЫиCЃЌПЩЗРжЙЖўМлбЧЬњРызгБЛбѕЛЏЁБЃЌгЩДЫПЩМћЮЌЩњЫиCОпга_________адЁЃ
ЂлМгШыKSCNШмвККѓЃЌдкЮДМгаТжЦТШЫЎЧАЃЌШмвКжавВВњЩњКьЩЋЃЌЦфПЩФмЕФдвђЪЧ ЁЃ
ЂмМгШыТШЫЎКѓЗЂЩњЕФЗДгІЕФРызгЗНГЬЪНЮЊ ЁЂ ЁЃ
ЂндкЪЕбщжаЗЂЯжЗХжУвЛЖЮЪБМфЃЌШмвКЕФбеЩЋЛсж№НЅЭЪШЅЁЃЧыФуЖдШмвКЭЪЩЋЕФдвђзїГі3жжВТЯыЁЃ
БрКХ | ВТ Яы |
Мз | |
вв | |
Бћ |
ЃЈ2ЃЉе§ГЃШЫУПЬьгІВЙГф14mgзѓгвЕФЬњЁЃЦфжаОјДѓВПЗжРДздгкЪГЮяЁЃШчЙћШЋВПЭЈЙ§ЗўгУКЌFeSO4ЁЄ7H2OЕФЦЌМСРДВЙГфЬњЃЌдђе§ГЃШЫУПЬьЗўашгУКЌ mg FeSO4ЁЄ7H2O ЮЊЦЌМСЁЃ
ЁОД№АИЁПЃЈ1ЃЉЂйACЃЛЂкЛЙдЃЛЂлЩйСПЕФFe2ЃЋБЛПеЦјжаЕФбѕЦјбѕЛЏЃЛ
Ђм 2Fe2ЃЋЃЋCl2ЃН2Fe3ЃЋЃЋ2ClЃЃЌFe3ЃЋЃЋ3SCNЃЃНFe(SCN)3ЃЛ
Ђн
БрКХ | ВТ Яы |
Мз | ШмвКжаЕФЃЋ3МлFeгжБЛЛЙдЮЊЃЋ2МлFe |
вв | ШмвКжаЕФSCNЃБЛЙ§СПЕФТШЫЎбѕЛЏ |
Бћ | аТжЦЕФТШЫЎОпгаЦЏАзадЃЌНЋИУШмвКЦЏАз |
ЃЈ2ЃЉ69.5 mgЁЃ
ЁОНтЮіЁПЪдЬтЗжЮіЃКЃЈ1ЃЉЂйИљОнc=n/V=m/MVЃЌAЁЂСПЭВПЬЖШДгЯТЕНЩЯдіДѓЃЌСПШЁХЈСђЫсЪБЃЌбіЪгЃЌСПШЁХЈСђЫсЕФЬхЛ§діДѓЃЌШмжЪЕФЮяжЪЕФСПдіДѓЃЌХЈЖШЦЋИпЃЌЙЪе§ШЗЃЛBЁЂШнСПЦПжагаЮоЫЎЃЌЖдЪЕбщЮогАЯьЃЌЙЪДэЮѓЃЛCЁЂЖЈШнЪБЃЌИЉЪгПЬЖШЯпЃЌШмвКЕФЬхЛ§ЦЋаЁЃЌХЈЖШЦЋИпЃЌЙЪе§ШЗЃЛDЁЂЖЈШнКѓЃЌдйМгЫЎЃЌЖдШмвКНјааЯЁЪЭЃЌХЈЖШЦЋЕЭЃЌЙЪДэЮѓЃЛЂкFe2ЃЋБЛбѕЛЏГЩFe3ЃЋЃЌЮЌЩњЫиCФмЗРжЙFe2ЃЋБЛбѕЛЏГЩFe3ЃЋЃЌЫЕУїЮЌЩњЫиCОпгаЛЙдадЃЛЂлFe2ЃЋОпгаЧПЛЙдадЃЌШнвзБЛПеЦјжабѕЦјбѕЛЏГЩFe3ЃЋЃЌвђДЫЩйСПЕФFe2ЃЋБЛПеЦјжаЕФбѕЦјбѕЛЏЃЛЂмТШЦјОпгаЧПбѕЛЏадЃЌФмАбFe2ЃЋбѕЛЏГЩFe3ЃЋЃЌМД2Fe2ЃЋЃЋCl2=2Fe3ЃЋЃЋ2ClЃЃЌШЛКѓFe3ЃЋКЭSCNЃЗЂЩњЃКFe3ЃЋЃЋ3SCNЃ=Fe(SCN)3ЃЛЂн
БрКХ | ВТ Яы |
Мз | ШмвКжаЕФЃЋ3МлFeгжБЛЛЙдЮЊЃЋ2МлFe |
вв | ШмвКжаЕФSCNЃБЛЙ§СПЕФТШЫЎбѕЛЏ |
Бћ | аТжЦЕФТШЫЎОпгаЦЏАзадЃЌНЋИУШмвКЦЏАз |
(2)ИљОнЬњдЊЫиЪиКуЃЌМДm(FeSO4ЁЄ7H2O)=14ЁС278/56mg=69.5mg.ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋЕШЮяжЪЕФСПЕФAЁЂBЁЂCЁЂDЫФжжЮяжЪЛьКЯЃЌЗЂЩњШчЯТЗДгІЃКaAЃЋbB![]() cCЃЈsЃЉЃЋdDЃЌЕБЗДгІНјаавЛЖЮЪБМфКѓЃЌВтЕУAМѕЩйСЫn molЃЌBМѕЩйСЫ
cCЃЈsЃЉЃЋdDЃЌЕБЗДгІНјаавЛЖЮЪБМфКѓЃЌВтЕУAМѕЩйСЫn molЃЌBМѕЩйСЫ![]() molЃЌCдіМгСЫ
molЃЌCдіМгСЫ![]() n molЃЌDдіМгСЫn molЁЃДЫЪБДяЕНЛЏбЇЦНКтзДЬЌЁЃ
n molЃЌDдіМгСЫn molЁЃДЫЪБДяЕНЛЏбЇЦНКтзДЬЌЁЃ
ЃЈ1ЃЉИУЛЏбЇЗНГЬЪНжаИїЮяжЪЕФЛЏбЇМЦСПЪ§ЃК
aЃН________ЃЌbЃН________ЃЌcЃН________ЃЌdЃН________ЁЃ
ЃЈ2ЃЉШєжЛИФБфбЙЧПЃЌЗДгІЫйТЪЗЂЩњБфЛЏЃЌЕЋЦНКтВЛЗЂЩњвЦЖЏЃЌИУЗДгІжаИїЮяжЪЕФОлМЏзДЬЌЃКA________ЃЌB____________ЃЌD___________ЁЃ
ЃЈ3ЃЉШєжЛЩ§ИпЮТЖШЃЌЗДгІвЛЖЮЪБМфКѓЃЌВтЕУЫФжжЮяжЪЦфЮяжЪЕФСПгжДяЕНЯрЕШЃЌдђИУЗДгІЕФе§ЗДгІЮЊ________ЗДгІЃЈЬюЁАЗХШШЁБЛђЁАЮќШШЁБЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕШМЩеУКЁЂЪЏгЭЕШЛЏЪЏШМСЯЪЭЗХГіДѓСПЕЊбѕЛЏЮя(NOx)ЁЂCO2ЁЂSO2ЕШЦјЬхЃЌбЯжиЮлШОПеЦјЁЃЖдЗЯЦјНјааЭбЯѕЁЂЭбЬМКЭЭбСђДІРэПЩЪЕЯжТЬЩЋЛЗБЃЁЂЗЯЮяРћгУЁЃ
I.ЭбЯѕЃКвбжЊЃКH2ЕФШШжЕЮЊ142.9 kJ/g(ШШжЕЪЧБэЪОЕЅЮЛжЪСПЕФШМСЯЭъШЋШМЩеЪБЫљЗХГіЕФШШСП)ЃЛ
N2(g) + 2O2(g)= 2NO2(g) ЁїH= +133 kJ/mol
H2O(g) =H2O(l) ЁїH=- 44 kJ/mol
ДпЛЏМСДцдкЯТЃЌH2ЛЙдNO2ЩњГЩЫЎеєЦјКЭЦфЫћЮоЖОЮяжЪЕФШШЛЏбЇЗНГЬЪНЮЊ_____________ЁЃ
Ђђ.ЭбЬМЃКЯђ2LУмБеШнЦїжаМгШы2 mol CO2ЁЂ6 mol H2ЃЌдкЪЪЕБЕФДпЛЏМСзїгУЯТЃЌЗЂЩњЗДгІ CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l)ЁЃ
CH3OH(l) + H2O(l)ЁЃ
ЃЈ1ЃЉЂйИУЗДгІздЗЂНјааЕФЬѕМўЪЧ___________(ЬюЁАЕЭЮТЁБЁАИпЮТЁБЛђЁАШЮвтЮТЖШЁБЃЉЁЃ
ЂкЯТСаа№ЪіФмЫЕУїДЫЗДгІДяЕНЦНКтзДЬЌЕФЪЧ___________ЁЃ
AЃЎЛьКЯЦјЬхЕФЦНОљЪНСПБЃГжВЛБф
BЃЎCO2КЭH2ЕФЬхЛ§ЗжЪ§БЃГжВЛБф
CЃЎCO2КЭH2ЕФзЊЛЏТЪЯрЕШ
DЃЎЛьКЯЦјЬхЕФУмЖШБЃГжВЛБф
e.1 mol CO2ЩњГЩЕФЭЌЪБга3 mol HЁЊHМќЖЯСб
ЂлCO2ЕФХЈЖШЫцЪБМф(0ЁЋt2)ЕФБфЛЏШчЭМЫљЪОЃЌдкt2ЪБНЋШнЦїШнЛ§ЫѕаЁвЛБЖЃЌt3ЪБДяЕНЦНКтЃЌt4ЪБНЕЕЭЮТЖШЃЌt5ЪБДяЕНЦНКтЃЌЧыЛГіt2ЁЋt6ЕФХЈЖШЫцЪБМфЕФБфЛЏЁЃ

ЃЈ2ЃЉИФБфЮТЖШЃЌЪЙЗДгІCO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) ЁїH<0жаЕФЫљгаЮяжЪЖМЮЊЦјЬЌЁЃЦ№ЪМЮТЖШЬхЛ§ЯрЭЌ(T1ЁцЁЂ2L.УмБеШнЦї)ЁЃЗДгІЙ§ГЬжаВПЗжЪ§ОнМћЯТБэЃК
CH3OH(g) + H2O(g) ЁїH<0жаЕФЫљгаЮяжЪЖМЮЊЦјЬЌЁЃЦ№ЪМЮТЖШЬхЛ§ЯрЭЌ(T1ЁцЁЂ2L.УмБеШнЦї)ЁЃЗДгІЙ§ГЬжаВПЗжЪ§ОнМћЯТБэЃК
ЗДгІЪБМф | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
ЗДгІI КуЮТКуШн | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
ЗДгІIIОјШШКуШн | 0 min | 0 | 0 | 2 | 2 |
ЂйДяЕНЦНКтЪБЃЌЗДгІIЁЂIIЖдБШЃКЦНКтГЃЪ§K( I ) __________K(II)(ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБЃЌЯТЭЌЃЉЃЛЦНКтЪБCH3OHЕФХЈЖШc(I)___ ________c(II)ЁЃ
ЂкЖдЗДгІIЃЌЧА10 minФкЕФЦНОљЗДгІЫйТЪv(CH3OH) =____________ЃЌдкЦфЫћЬѕМўВЛБфЯТЃЌШє30 minЪБжЛИФБфЮТЖШЮЊT2ЁцЃЌДЫЪБH2ЕФЮяжЪЕФСПЮЊ3.2 molЃЌдђT1_________T2(ЬюЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)ЁЃШє30 minЪБжЛЯђШнЦїжадйГфШы1 mol CO2(g)КЭ1mol H2O(g)ЃЌдђЦНКт ______________вЦЖЏ(ЬюЁАе§ЯђЁБЁЂЁАФцЯђЁБЛђЁАВЛЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈжае§ШЗЕФЪЧ( )
AЃЎЛЏбЇЗДгІжаЃЌЮяжЪБфЛЏЕФЭЌЪБВЛвЛЖЈЗЂЩњФмСПБфЛЏ
BЃЎЗДгІьЪБф(ЁїH)ЕФДѓаЁгыЗНГЬЪНжаИїЮяжЪЕФЛЏбЇМЦСПЯЕЪ§ЮоЙи
CЃЎЗДгІВњЮяЕФзмьЪДѓгкЗДгІЮяЕФзмьЪЪБЃЌЗДгІЮќШШЃЌЁїH>0
DЃЎЮќШШЗДгІжаЃЌаЮГЩЛЏбЇМќЪЭЗХЕФФмСПДѓгкЖЯСбЛЏбЇМќЮќЪеЕФФмСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСадзгжаЮДГЩЖдЕчзгзюЖрЕФЪЧЃЈ ЃЉ
A. C B. O C. N D. Cl
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдЭтМгЕчСїЕФН№ЪєБЃЛЄжаЃЌБЛБЃЛЄЕФН№Ъє( )
A. гыЕчдДЕФе§МЋЯрСЌ B. БэУцЩЯЗЂЩњбѕЛЏЗДгІ
C. гыЕчдДЕФИКМЋЯрСЌ D. гыСэвЛжжЛюЦУадНЯВюЕФН№ЪєЯрСЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙидзгНсЙЙЕФЫЕЗЈЃЌе§ШЗЕФЪЧ ЃЈ ЃЉ
A. ЯЁгаЦјЬхдЊЫидзгЕФзюЭтВуЕчзгЪ§ЖМЪЧ8 B. ЗЧН№ЪєдЊЫиЕФзюЭтВуЕчзгЪ§ЖМДѓгк3
C. Н№ЪєдЊЫиЕФзюЭтВуЕчзгЪ§ЖМаЁгк4 D. ЧтдзгЕФЕчзгдЦЪЧЧђаЮЖдГЦЕФ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБНМзЫсЙуЗКгІгУгкжЦвЉКЭЛЏЙЄаавЕЃЌФГЭЌбЇГЂЪдгУМзБНЕФбѕЛЏЗДгІжЦБИБНМзЫсЁЃЗДгІдРэЃК
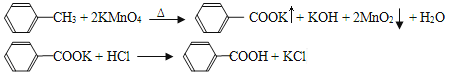
МКжЊМзБНЕФШлЕуЮЊ-95ЁуCЃЌЗаЕуЮЊ110.6ЁуCЃЌвзЛгЗЂЃЌУмЖШЮЊ0.866g/cm3ЃЛБНМзЫсЕФШлЕуЮЊ122.4ЁуC,дк25ЁуCКЭ95ЁуCЯТШмНтЖШЗжБ№ЮЊ0.3gКЭ6.9gЁЃ
ЁОжЦБИВњЦЗЁПНЋ30.0mLМзБНКЭ25.0mLlmol/LИпУЬЫсМиШмвКдк100ЁуCЯТЗДгІ30minЃЌзАжУШчЭМЫљЪОЁЃ
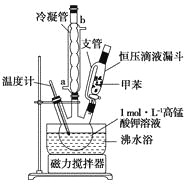
ЃЈ1ЃЉЭМжаРфФ§ЙмЕФНјЫЎПкЮЊ________(ЬюЁАaЁБЛђЁАbЁБЃЉЁЃжЇЙмЕФзїгУЪЧ___________ЁЃ
ЃЈ2ЃЉдкБОЪЕбщжаЃЌШ§СьЩеЦПзюКЯЪЪЕФШнЛ§___________(ЬюзжФИЃЉЁЃ
AЃЎ50mL | BЃЎI00mL | CЃЎ200mL | DЃЎ250mL |
ЯрЖдгкгУОЦОЋЕЦжБНгМгШШЃЌгУЗаЫЎдЁМгШШЕФгХЕуЪЧ___________________ЁЃ
ЁОЗжРыВњЦЗЁПИУЭЌбЇЩшМЦШчЯТСїГЬЗжРыДжВњЦЗБНМзЫсКЭЛиЪеМзБН
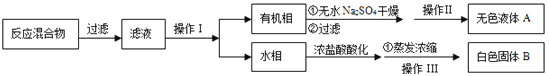
ЃЈ3ЃЉВйзїЂёЕФУћГЦЪЧ ЃЛКЌгадгжОЕФВњЮяОВйзїЂђНјвЛВНЬсДПЕУЮоЩЋвКЬхМзБНЃЌдђВйзїЂђЕФУћГЦЪЧ ЁЃ
ЃЈ4ЃЉВтЖЈАзЩЋЙЬЬхЕФШлЕуЃЌЗЂЯжЦфдк115ЁцПЊЪМШлЛЏЃЌДяЕН130ЁцЪБШдгаЩйСПВЛШлЃЌИУЭЌбЇЭЦВтАзЩЋЙЬЬхЪЧБНМзЫсгыKClЕФЛьКЯЮяЃЌЩшМЦСЫШчЯТЗНАИНјааЬсДПКЭМьбщЃЌЪЕбщНсЙћБэУїЭЦВте§ШЗЁЃЧыЭъГЩБэжаФкШнЁЃ
ађКХ | ЪЕбщЗНАИ | ЪЕбщЯжЯѓ | НсТл |
Ђй | НЋАзЩЋЙЬЬхМгШыЫЎжаЃЌМгШШШмНтЃЌ______ЁЃ | ЕУЕНАзЩЋОЇЬхКЭЮоЩЋШмвК | |
Ђк | ШЁЩйжиТЫвКгкЪдЙмжаЃЌ________ЁЃ | ЩњГЩАзЩЋГСЕэ | ТЫвККЌCl- |
Ђл | ИЩдяАзЩЋОЇЬхЃЌ________ЁЃ | _____________________ | АзЩЋОЇЬхЪЧБНМзЫс |
ДПЖШВтЖЈЃКГЦШЁ1.220gВњЦЗЃЌХфГЩ100mlМзДМШмвКЃЌШЁ25.00mlШмвКЃЌгУ0.1000mol/L KOHБъзМШмвКЕЮЖЈЃЌжиИДЕЮЖЈЫФДЮЃЌУПДЮЯћКФЕФЬхЛ§ШчЯТБэЫљЪОЁЃ
ЕквЛДЮ | ЕкЖўДЮ | ЕкШ§ДЮ | ЕкЫФ | |
ЬхЛ§ЃЈmLЃЉ | 24.00 | 24.10 | 22.40 | 23.90 |
ЃЈ5ЃЉЕЮЖЈВйзїжаЃЌШчЙћЖдзАгаKOHБъзМШмвКЕФЕЮЖЈЙмЖСЪ§ЪБЃЌЕЮЖЈЧАбіЪгЃЌЕЮЖЈКѓИЉЪгдђВтЖЈНсЙћ______________ЃЈЬюЁАЦЋДѓЁБЁЂЁАЦЋаЁЁБЛђЁАВЛБфЁБЃЉЁЃМЦЫубљЦЗжаБНМзЫсДПЖШЮЊ______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃбѓжВЮяШчКЃДјЁЂКЃдхжаКЌгаЗсИЛЕФЕтдЊЫиЃЌжївЊвдЕтЛЏЮяаЮЪНДцдкЃЎгавЛЛЏбЇПЮЭтаЁзщгУКЃДјЮЊдСЯжЦШЁЩйСПЕтЕЅжЪЃЌЫћУЧНЋКЃДјзЦЩеГЩЛвЃЌгУЫЎНўХнвЛЖЮЪБМф(вдШУЕтЛЏЮяГфЗжШмНтдкЫЎжаЃЉЃЌЕУЕНКЃДјЛваќзЧвКЃЌШЛКѓАДвдЯТЪЕбщСїГЬЬсШЁЕЅжЪЕтЃК
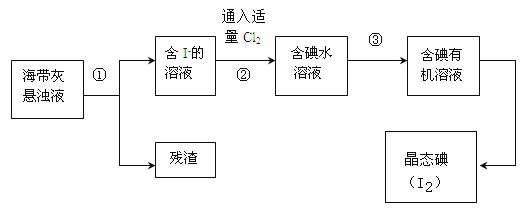
ЃЈ1ЃЉзЦЩеКЃДјЪБашвЊгУЕНЕФЪЕбщвЧЦїЪЧ (ДгЯТСавЧЦїжабЁГіЫљашЕФвЧЦїЃЌгУБъКХзжФИЬюаДдкПеАзДІЃЉЃЎ
AЩеБ BлсЙј CеєЗЂУѓ DЬњМмЬЈ(ДјЬњШІЃЉ EОЦОЋЕЦ FИЩдяЦї
ЃЈ2ЃЉжИГіЬсШЁЕтЕФЙ§ГЬжагаЙиЕФЪЕбщВйзїУћГЦЃКЂй ЃЌЂл ЃЛ
ЃЈ3ЃЉЙ§ГЬЂкжаГфШыЪЪСПCl2ЕФФПЕФЪЧ ЃЌЗДгІЕФРызгЗНГЬЪНЮЊ ЃЛ
ЃЈ4ЃЉВйзїЂлжаЫљгУЕФгаЛњЪдМСПЩвдЪЧ (жЛЬювЛжжЃЉЃЌМђЪібЁдёЦфРэгЩ ЁЃ
ЃЈ5ЃЉВйзїЙ§ГЬЂлПЩвдЗжНтЮЊШчЯТМИВНЃК
AЃЎАбЪЂгаШмвКЕФЗжвКТЉЖЗЗХдкЬњМмЬЈЕФЬњШІжаЃЛ
BЃЎАб50mLЕтЫЎКЭ15mLгаЛњШмМС(ФуЫљбЁЕФЃЉМгШыЗжвКТЉЖЗжаЃЌВЂИЧКУВЃСЇШћЃЛ
CЃЎМьбщЗжвКТЉЖЗЛюШћКЭЩЯПкЕФВЃСЇШћЪЧЗёТЉвКЃЛ
DЃЎЕЙзЊТЉЖЗгУСІеёЕДЃЌВЂВЛЪБа§ПЊЛюШћЗХЦјЃЌзюКѓЙиБеЛюШћЃЌАбЗжвКТЉЖЗЗХе§ЃЛ
EЃЎа§ПЊЛюШћЃЌгУЩеБНгЪеШмвКЃЛ
FЃЎДгЗжвКТЉЖЗЩЯПкЕЙГіЩЯВувКЬхЃЛ
GЃЎНЋТЉЖЗЩЯПкЕФВЃСЇШћДђПЊЛђЪЙШћЩЯЕФАМВлгыТЉЖЗЩЯПкЕФаЁПзЖдзМЃЛ
HЃЎОВжУЁЂЗжВуЃЎ
aЃЎЩЯЪіGВНВйзїЕФФПЕФЪЧЃК ЃЛ
bЃЎзюКѓЕтЕФгаЛњШмвКЪЧЭЈЙ§ ЛёЕУ(ЬюЁАТЉЖЗЩЯПкЁБЛђЁАТЉЖЗЯТПкЁБЃЉЁЃ
ЃЈ6ЃЉЧыЩшМЦвЛжжМьбщЬсШЁЕтКѓЕФЫЎШмвКжаЪЧЗёЛЙКЌгаЕЅжЪЕтЕФМђЕЅЗЈЃК ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com