


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
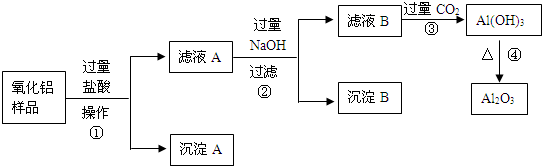
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
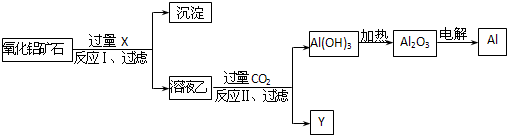
| A、试剂X可以为氨水,沉淀中含有铁的化合物 |
| B、CO2可以用H2SO4溶液或稀盐酸代替 |
| C、反应II中的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、工业上还可采用Fe还原Al2O3的方法制Al,成本更低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
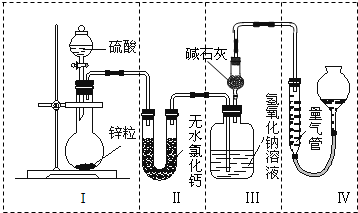 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.38mol |
| B、0.50mol |
| C、0.62mol |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
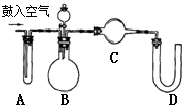 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.查看答案和解析>>
科目:高中化学 来源: 题型:
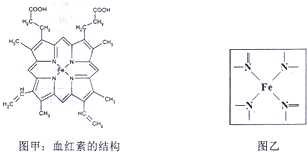
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com