
 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.| m2-m1 |
| 44 |
| ||
| n |
| 53(m2-m1) |
| 22 |
| 53(m2-m1) |
| 22 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、C(H+)和C(OH-)的乘积 | ||
| D、OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从溴水中提取溴--分液 |
| B、分离水和汽油的混合物--蒸馏 |
| C、从硝酸钾和氯化钾混合液中获取硝酸钾--蒸发 |
| D、分离饱和食盐水和沙子的混合物--过滤 |
查看答案和解析>>
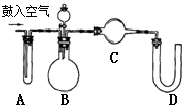
科目:高中化学 来源: 题型:
查看答案和解析>>
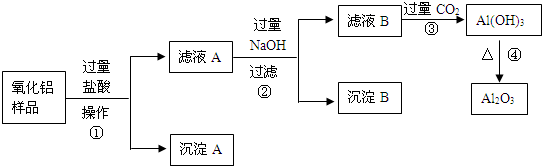
科目:高中化学 来源: 题型:
查看答案和解析>>
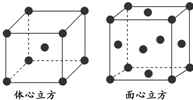
科目:高中化学 来源: 题型:
| 化学键 | B-H | B-0 | B-B |
| 键能(kj?mol-1) | 389 | 561 | 293 |
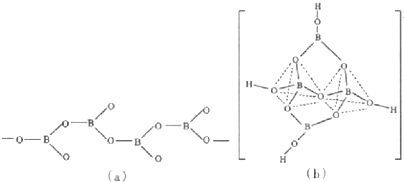
查看答案和解析>>
科目:高中化学 来源: 题型:
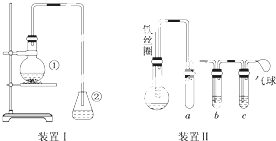 为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④②③①⑤ |
| B、②④①⑤③ |
| C、①③⑤②④ |
| D、④②①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com