
A、
| ||
B、
| ||
| C、C(H+)和C(OH-)的乘积 | ||
| D、OH-的物质的量 |
| c(OH-) |
| c(NH3?H2O) |
| n(OH-) |
| n(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |


科目:高中化学 来源: 题型:
| 元素代号 | U | V | W | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 | 0.143 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
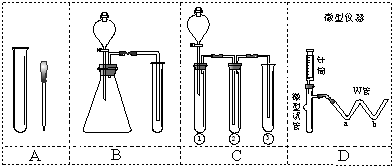
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:
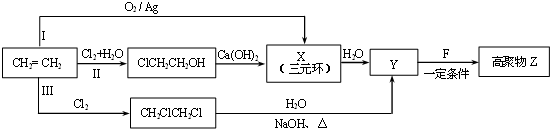
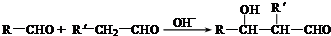 (R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
(R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.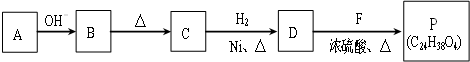
查看答案和解析>>
科目:高中化学 来源: 题型:
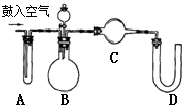 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com