
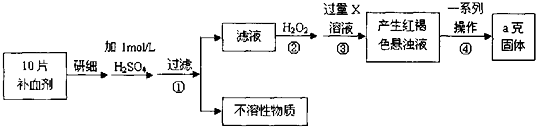
分析 由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+;
(2)由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.步骤②加入过量H2O2的是将Fe2+氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,试剂X可以是氢氧化钠或氨水等;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(5)根据氧化铁的质量计算铁元素的质量.注意ag氧化铁含有的铁元素质量为10片含有的铁元素质量;
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
②KMnO4溶液需要酸化,用于酸化的酸不能具有强氧化性氧化Fe2+,不能具有强还原性被高锰酸钾氧化,否则会影响高锰酸钾溶液的体积;
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色;
(7)根据一定质量的化合物中组成元素的质量=化合物的质量×该元素的质量分数,由FeSO4•7H2O中铁元素的质量分数及14mg左右的铁计算FeSO4•7H2O的质量;
解答 解:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+检验Fe2+,可以先滴加KSCN溶液,溶液不变色,加入氯水(或双氧水、稀硝酸),发生2Fe2++Cl2═2Fe3++2Cl-,溶液变为血红色,发生Fe3++3SCN-?Fe(SCN)3,说明含有Fe2+,
故答案为:氯水(或双氧水、稀硝酸);溶液开始不变色,后变为血红色;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:将Fe2+全部氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,加入氨水,反应离子方程式为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤、干燥得到氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤、干燥;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量$\frac{ag×\frac{112}{160}}{10}$=0.07ag,故答案为:0.07a;
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶,故答案为:250mL容量瓶;
②稀硝酸、浓硝酸具有强氧化性,含有氧化Fe2+,高锰酸钾可以氧化HCl为氯气,故选硫酸酸化,故选B,
故答案为:B;
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,
故答案为:紫;
(7)正常人每天应补充14mg左右的铁,则每天约需要服用含FeSO4•7H2O的质量=$\frac{14mg}{\frac{56}{278}×100%}$×100%=69.5mg,
故答案为:69.5mg;
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 互为同分异构体 | B. | 互为同系物 | C. | 只能是同种物质 | D. | 最简式一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2C2O4水解:C2O42-+2H2O═H2C2O4+2OH- | |
| B. | NH4HSO3溶液与少量NaOH溶液混合:HSO3-+OH-═SO32-+H2O | |
| C. | 将FeS溶液加入过量稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═CO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①、② | B. | ①、③ | C. | ②、③ | D. | ①、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
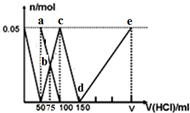
| A. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol•L-1 | |
| D. | d→e的过程中水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
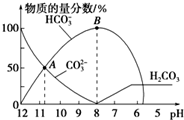
| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是Na+ | |
| C. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| D. | 25℃时,CO32-水解常数Kh=2×10-4mol•L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苯丙酸诺龙分子中没有手性碳原子 | |
| B. | 苯丙酸诺龙属于芳香烃 | |
| C. | 苯丙酸诺龙既能使溴的四氯化碳溶液又能使酸性KMnO4溶液褪色 | |
| D. | 1mol苯丙酸诺龙最多可与2 mol的NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com