
A.使用催化剂 B.升高反应温度
C.增大反应物浓度 D.降低气体生成物的压强
科目:高中化学 来源: 题型:阅读理解
(1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为__________________,多余的氯气可用绿矾吸收,反应的离子方程式为____________________________________________________________________。
(2)氯气用于自来水消毒除有异味外,近来发现能产生500多种有致癌、致畸作用的有机氯衍生物,如CHCl3、CCl2Br2等。写出CH4与Cl2反应生成CHCl3的化学方程式:
__________________;__________________;__________________。
以上反应均属于_________反应(填有机反应类型),由此可知,每生成1 mol CHCl3,消耗Cl2的物质的量_________ (填“大于”“等于”或“小于”)3 mol。
(3)用高铁酸钠(Na2FeO4)对来自河、湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4能用于饮用水消毒和净化处理的原因分析正确的是( )
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.Na2FeO4的还原产物是Fe3+,易水解生成Fe(OH)3,可使水中悬浮物凝聚沉降
C.Na2FeO4的还原产物是Fe2+,易水解为Fe(OH)2,可使水中悬浮物凝聚?沉降
D.Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
高铁(Ⅵ)酸盐是新一代水处理剂,其制备方法有次氯酸盐氧化法(湿法):该法是在碱性溶液中,利用次氯酸盐氧化三价铁盐,试写出并配平这一离子反应方程式:__________________。
(4)我国南方某些地区的井水取来久置后,由澄清透明变成有少量棕红色絮状沉淀沉积于缸底,水面浮着一层“锈皮”,当地居民常采用加明矾的方法处理。①井水久置后,水面浮着的一层“锈皮”的主要成分是_________(写化学式)。②用化学方法鉴别该井水的步骤是__________________;离子方程式是__________________。③用化学方法鉴别经明矾处理后的水的步骤是__________________;离子方程式是__________________。④AlCl3·6H2O(代号AC)和[Al2(OH)nCl6-n]m(代号BAC)都可以作为水澄清剂。它们对水的pH改变的影响是否一样大?_________;原因是什么?__________________。
(5)X物质也可用于自来水消毒,既能提高消毒效率,又安全、无异味、无副作用,该物质在自然界中存在,对地球生物起保护伞作用。X的化学式是_________。X能使湿润的淀粉碘化钾试纸变蓝,试写出该反应的化学方程式:__________________。该反应过程中氧化产物和还原产物的物质的量之比为_________。
(6)ClO2被称为“第四代”饮用水杀菌剂,因其高效、无污染而被广泛使用。我国北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为![]() +4 H+
+4 H+![]() 4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
答:________(填“能”或“不能”),理由是________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届云南省高二6月月考化学卷(解析版) 题型:填空题
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体又可用于验证物质的性质。请回答下列问题:
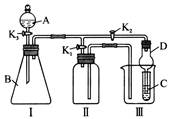
(1)利用装置Ⅰ制取气体,生成气体的反应应具备的条件是 。
(2)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是:
_______________________________________________________________________;
乙同学认为:对装置Ⅱ做简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是 ;不能收集NO2气体的原因是(用化学方程式表示) ;
(3)利用装置Ⅰ、Ⅲ 验证物质的性质(K2打开,K1关闭)。如要设计实验证明氧化性
KMnO4>Cl2>Br2,则可在A 中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
I.完成下列离子方程式(给出物质的计量数不能改变)
(1) +6H+=2Fe3++3
(2) +Ca2++2 =CaCO3↓+
II.常温下有浓度均为0.5mol/L的五种溶液:①NaHCO3;②C6H5ONa;③ NH4HCO3;④ NH3.H2O;⑤ HCl
(1)上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示) 。
(3)③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
.
(4)加热④,溶液中的c(OH-)的变化有甲乙两种猜想,请设计实验探究证明
甲:c(OH-)将增大。升高温度有利于电离平衡移动,使氨水中c(OH-)增大。
乙:c(OH-)将减小。受热时温度升高氨气逸出,使c(OH-)减小
实验设计:
.
(5)取10mL溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)=
mol/L. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com