
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气。
写出Al4C3与硫酸反应的化学方程 。
(2)实验装置(如图所示):
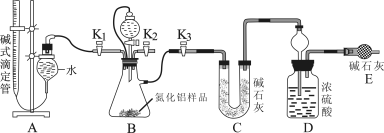
(3)实验过程:
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3 ,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3 ,通过分液漏斗加入过量NaOH ,与装置B瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L·mol-1)
①Al4C3的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”下同)。若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的体积 。
③AlN的质量分数为 。
【答案】
(1)Al4C3 +6H2SO4==2Al2(SO4)3+3CH4↑
(3)④打开K2通入空气一段时间
(4)① ![]() ;②偏小;偏大;③
;②偏小;偏大;③![]() ×100%
×100%
【解析】
试题分析:(1)Al4C3与硫酸反应的化学方程式为Al4C3 +6H2SO4==2Al2(SO4)3+3CH4↑,故答案为:Al4C3 +6H2SO4=2Al2(SO4)3+3CH4↑;
(3)实验过程:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数。通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,故应关闭活塞K2、K3,打开活塞 K1。用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数。故应关闭活塞K1,打开活塞K3由②中分析可知,通过分液漏斗加入过量氢氧化钠溶液,装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收,防止测定的氨气的质量偏小,故答案为:打开K2,通入空气一段时间;
(4)数据分析:
①甲烷的体积为(a-b)mL,物质的量为![]() =
=![]() ×10-3mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为
×10-3mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为![]() ×
×![]() ×10-3mol×144g/mol=
×10-3mol×144g/mol=![]() ×10-3g,Al4C3的质量分数为
×10-3g,Al4C3的质量分数为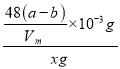 ×100%=
×100%=![]() ×100%.故答案为:
×100%.故答案为:![]() ×100%。
×100%。
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的的压强小于外界大气压,使得所测气体的体积偏大,故答案为:偏小;偏大;
③氨气的质量为(z-y)g,物质的量为![]() =
=![]() mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为
mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为![]() mol×41g/mol=
mol×41g/mol=![]() g,故AlN的质量分数为
g,故AlN的质量分数为![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】月球表面土壤里有1种非常有用的资源3He——可控核聚变的原料,有关叙述正确的是( )
A. 在3He中存在:质子数=中子数=核外电子数
B. 3He和4He是同种原子
C. 核聚变时,原子核发生了变化,发生了化学反应
D. 3He和4He互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生反应是2Cu+===Cu2++Cu 。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 (填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式 。
(3)CuH溶液在稀盐酸中生成的气体是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量含Cu、Cu2O、和CuO的固体混合物,将其分成两等份并进行下列转化:
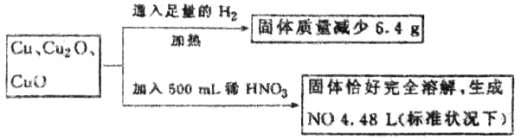
则转化过程中所加稀HNO3的物质的量浓度为( )
A.3.2mol/L B.3.6mol/L C.4.0mol/L D.4.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯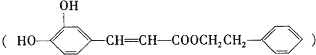 是一种天然抗癌药物,在一定条件下能发生如下转化
是一种天然抗癌药物,在一定条件下能发生如下转化
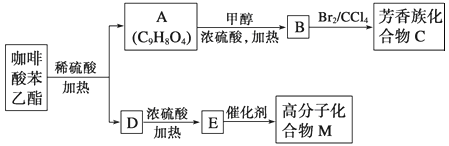
请回答下列问题:
(1)D分子中的官能团是__________;
(2)高分子化合物M的结构简式是__________;
(3)写出A→B反应的化学方程式:__________;
(4)B→C的反应类型为__________;
(5)1molA最多可消耗__________molNaOH;
(6)一定条件下1molA最多与__________mol氢气加成
(7)A的同分异构体有很多种,其中,同时符合下列条件的同分异构体的结构简式:__________
①苯环上只有两个取代基 ②能发生银镜反应 ③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铜和稀硝酸反应产生一氧化氮气体,某学校学生实验小组设计了一个实验,其装置如下图所示(加热装置与固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球。
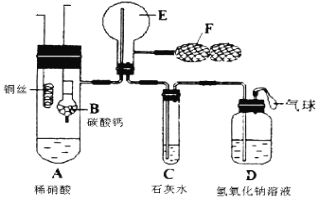
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
(3)装置E中开始时出现浅红棕色,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深。假设装置E的体积为66mL,空气残留量为10mL,要鼓入 mL的空气才能将NO全部氧化(设氧气占空气体积的1/5,且所有气体都在同温同压下)。
(4)一段时间后,C中白色沉淀溶解,其原因是 、 (用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com