
【题目】将足量的氯气通入下列溶液中,溶质阴、阳离子的数目都明显改变的是( )
A.FeBr2 B.AgNO3 C.NaOH D.Na2CO3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列说法正确的是
A.氮的固定是指将气态氮气变为固态
B.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
C.金属可分为“黑色金属”和“有色金属”,铁及其合金都属于“有色金属”
D.包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气。
写出Al4C3与硫酸反应的化学方程 。
(2)实验装置(如图所示):
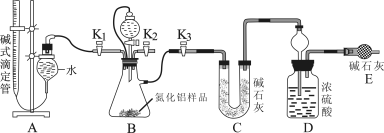
(3)实验过程:
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3 ,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3 ,通过分液漏斗加入过量NaOH ,与装置B瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L·mol-1)
①Al4C3的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”下同)。若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的体积 。
③AlN的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁是日常生活中用途广泛的金属。
(1)常温下,可用铝和铁质容器盛装浓硫酸的原因是____ 。
(2)但是铝制容器不能装NaOH等碱溶液,原因是(用离子方程式表示) ;
(3)工业上冶炼铝,反应的化学方程式为_
(4)某实验小组利用右图装置验证铁与水蒸气的反应。
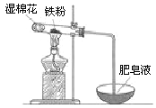
①湿棉花的作用是 ,试管中反应的化学方程式是 _。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是___________(填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲制取较纯净的1,2二氯乙烷,可采取的方法是
A.乙烯与氯化氢加成
B.乙烯与氯气加成
C.乙烷与氯气以1∶2的体积比在光照条件下反应
D.乙烯先与氯化氢加成,再与等物质的量的氯气在光照下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A. 利用金属钠或者金属钾
B. 利用质谱法
C. 利用红外光谱法
D. 利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二乙酸-1,4-环己二醇酯可以通过下列路线合成。请回答下列问题:

(1)反应①—④中,属于取代反应的有 (填序号);
反应⑥—⑧中,属于加成反应的有 (填序号)。
(2)写出下列物质的结构简式:B ,C 。
(3)写出下列反应的方程式
反应②: ;
反应⑦:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上综合利用铝土矿的部分工艺流程如下。
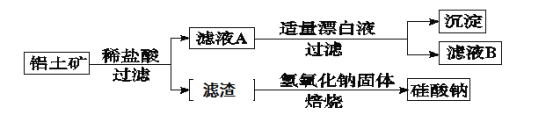
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ = □Fe(OH)3↓+□C1-+ 。
(2)检验滤液B中是否还含有Fe2+的方法为: 。
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
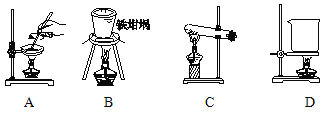
(5)滤渣的主要成分是 (填化学式),其与NaOH固体焙烧制备硅酸钠,可采用的装置为 (填代号),该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应:N2(g)+O2(g)![]() 2NO(g)ΔH >0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g)ΔH >0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_____________________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ 。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下图变化趋势正确的是____________(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数________。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应___________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com