
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应:N2(g)+O2(g)![]() 2NO(g)ΔH >0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g)ΔH >0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_____________________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ 。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下图变化趋势正确的是____________(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数________。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应___________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是________________________________ 。
【答案】(1)0.05mol/(L·min);(2)AD;(3)AC;(4)不变;(5)向正向进行;浓度商小于平衡常数。
【解析】
试题分析:(1)根据化学反应速率数学表达式,v(O2)=(1-0.5)/(2×5)mol/(L·min)=0.05 mol/(L·min);(2)A、用不同物质的反应速率表示达到平衡,要求反应方向一正一逆,且反应速率之比等于系数之比,故正确;B、ρ=m/v,条件是恒容,v不变,反应物和生成物都是气体,气体质量不变,因此密度不能作为达到平衡的标志,故错误;C、M=m/n,气体的质量不变,气体系数之和相等,n不变,因此平均相对分子质量不变,不能作为达到平衡的标志,故错误;D、根据A的分析,故正确;(3)化学平衡常数K=c2(NO)/[c(NO)×c(O2)],此反应是吸热反应,升高温度,平衡向正反应方向移动,化学平衡常数只受温度的影响,因此随着温度的升高,化学平衡常数增大,故正确;B、催化剂只增大反应速率,对化学平衡无影响,故错误;C、先拐先平衡,说明反应速率快,即T1>T2,此反应是吸热反应,升高温度,平衡向正反应方向移动,N2的转化率增大,故正确;(4)再充入NO,相当于在原来的基础增大压强,因为反应前后气体系数之和相等,即平衡不移动,NO的体积分数不变;(5)此时的Qc=(3×10-3)2/[(2.5×10-1×4×10-2]=9×10-4,上述反应达到平衡时的化学平衡常数为K=64×10-4,Qc<K,说明反应向正反应方向移动。


科目:高中化学 来源: 题型:
【题目】为了证明铜和稀硝酸反应产生一氧化氮气体,某学校学生实验小组设计了一个实验,其装置如下图所示(加热装置与固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球。
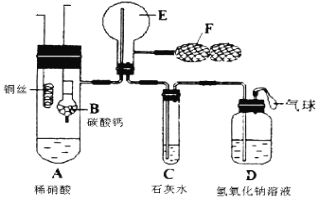
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
(3)装置E中开始时出现浅红棕色,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深。假设装置E的体积为66mL,空气残留量为10mL,要鼓入 mL的空气才能将NO全部氧化(设氧气占空气体积的1/5,且所有气体都在同温同压下)。
(4)一段时间后,C中白色沉淀溶解,其原因是 、 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解NaCl溶液生成氯气的化学方程式为 。
(2)Cl2溶于H2O、NaOH溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl2与H2O、NaOH的反应如下:
反应Ⅰ | Cl2+H2O |
反应Ⅱ | Cl2+2OH- |
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如图所示:
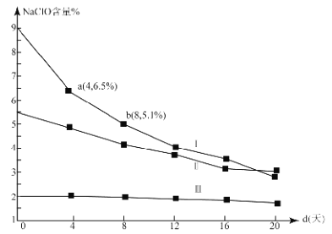
①分解速率v(Ⅰ) v(Ⅱ)(填“>”“<”或“=”),原因是 。
②NaClO分解的化学方程式是 。
③4d-8d,Ⅰ中v(NaClO)= mol/(L·d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境保护、工业生产、生活等密切相关,下列说法不正确的是
A. 用钢瓶储存液氯或浓硫酸
B. 硅胶可用作食品干燥剂
C. PM 2.5是指大气中直径接近2.5×10-6 m的颗粒物,它分散在空气中形成胶体
D. 神舟10号飞船所用太阳能电池板的材料是单晶硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
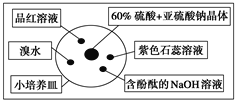
A. 紫色石蕊溶液变红色,说明SO2呈酸性
B. 品红溶液褪色,说明SO2具有漂白性
C. 溴水橙色褪去,体现了SO2的还原性
D. 含酚酞的NaOH溶液红色变浅,表明SO2能够和NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
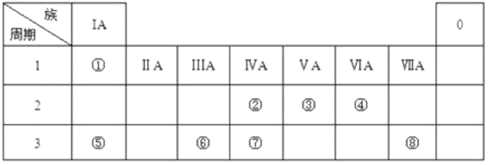
(1)地壳中含量最高的金属元素在周期表中的位置是 ;
(2)⑧形成的单质与水反应的离子方程式为 ;
(3)②⑦的非金属性强弱可通过比较这两种元素 (填编号)
a、原子的得电子能力
b、含氧酸的酸性
c、气态氢化物的稳定性
d、单质的熔点
(4)写出一种由④⑤⑧元素组成的既含离子键又含有共价键的物质的电子式 。
(5)化工行业最近合成了由②和③形成的化合物,其硬度比金刚石还大,该物质所形成的晶体还可能具有的性质或特点有 。(填编号)
①熔点很高 ②可以导电 ③不存在单个分子 ④具有空间网状结构
(6)①和③形成的某液态化合物摩尔质量与氧气相同,在常温常压下0.25mol该液态物质在足量的氧气中完全燃烧生成③的气态单质和液态水,同时放出QkJ的热量。写出该反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com