
【题目】按要求回答问题:
(1)已知E1=134 kJ/mol、E2=368 kJ/mol,请参考题中图表,按要求填空:

①图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是_______(填“增大”、“减小”或“不变”,下同),ΔH的变化是_______。NO2和CO反应的热化学方程式为:______________________________________________________________。
②下表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知P4(g)+5O2(g)= P4O10(g) ΔH=-d kJ/mol,P4及P4O10的结构如图Ⅱ所示。表中x=___kJ/mol。(用含a、b、c、d的代数式表示)
(2)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa,298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是_______________________。
又知:H2O(g)=H2O(l)△H=-44 kJ/mol,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为__________kJ。
【答案】减小不变NO2(g)+CO(g)=CO2(g)+NO(g) △H = 234kJ/mol(6a+5c+d-12b)/4N2H4(l)+O2(g)=N2(g)+2H2O(g) △H = 624kJ/mol712
【解析】
(1). ①.加入催化剂能降低反应的活化能,则E1减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不变,所以催化剂对反应热无影响,由图可知,1molNO2和1molCO反应生成CO2和NO时放出热量368kJ-134kJ=234kJ,热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol,故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol;
②. 白磷燃烧的热化学方程式为P4(g)+5O2(g)= P4O10(g) ΔH=-d kJ/mol,1mol白磷完全燃烧需拆开6molPP、5molO=O,形成12molPO、4molP=O,所以12mol×bkJ/mol+4mol×xkJ/mol(6mol×akJ/mol+5mol×ckJ/mol)=dkJ/mol,x=(6a+5c+d12b)/4kJ/mol,故答案为:(6a+5c+d12b)/4;
(2). 在101kPa,298K时,1mol液态肼与足量氧气反应生成氮气和水蒸气,放出624kJ的热量,则该反应的热化学方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=624kJ/mol,如果生成液态水,1mol肼完全反应放出的热量为:624kJ+44×2kJ=712kJ,故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=624kJ/mol;712。


科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__________、__________。
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是__________。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式____________________。
③C的作用是__________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”);滴定时边滴边摇动锥形瓶,眼睛应观察__________。
②滴定结果如下表所示
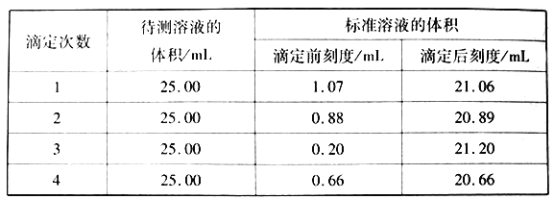
该样品中氮的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
诺氟沙星为喹诺酮类抗生素,其合成路线如下:
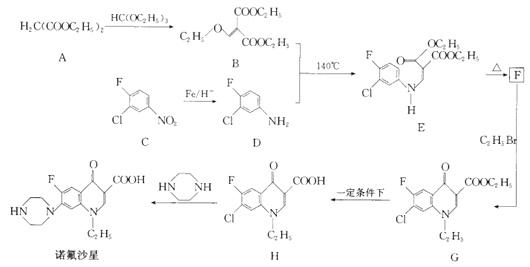
回答下列问题:
(1)化合物A的名称是____________。
(2)诺氟沙星分子中含氧官能团的名称为____________。
(3)C生成D,H生成诺氟沙星的反应类型分别是___________、___________。
(4)F的结构简式为_______________。
(5)G生成H的化学方程式为__________________。
(6)有机物X比B分子少一个CH2原子团,且含有酯基和![]() 结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
(7)参照上述合成路线写出由有机物![]() 、B为有机原料合成
、B为有机原料合成 的路线图______________(无机试剂任选)。
的路线图______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应 3Cu+8HNO3→3Cu(NO3)2+2NO↑+4H2O 中,硝酸中被还原和未被还原的氮元素的质量比是
A. 3:1 B. 1:1 C. 1:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )

A. 该反应的ΔH=+91 kJ·mol-1
B. 加入催化剂,该反应的ΔH变小
C. 反应物的总能量小于生成物的总能量
D. 如果该反应生成液态CH3OH,则ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油化工生产中,利用裂解反应可以获得重要化工原料乙烯、丙烯。一定条件下,正丁烷裂解的主反应如下:
反应I C4H10(g)![]() CH4(g)+CH3CH-CH3(g) △H1;
CH4(g)+CH3CH-CH3(g) △H1;
反应Ⅱ C4H10(g)![]() C2H6(g)+CH2=CH2(g) △H2;
C2H6(g)+CH2=CH2(g) △H2;
回答下列问题:
(1)正丁烷、乙烷和乙烯的燃烧热分别为Q1kJ·mol-1、Q2kJ·mol-1、Q3kJ·mol-1,反应Ⅱ的△H2=______________。
(2)一定温度下,向容积为5L的密闭容器中通入正丁烷,反应时间(t)与容器内气体总压强(p)数据如下:
t/min | 0 | a | 2a | 3a | 4a |
p/MPa | 5 | 7.2 | 8.4 | 8.8 | 8.8 |
①该温度下,正丁烷的平衡转化率a=__________;反应速率可以用单位时间内分压的变化表示,即v=![]() ,前2a min内正丁烷的平均反应速率
,前2a min内正丁烷的平均反应速率![]() =__________MPa·min-1。
=__________MPa·min-1。
②若平衡时甲烷、乙烯的体积分数分别为![]() 、
、![]() ,则该温度下反应I的压力平衡常数Kp=_________MPa(用平衡分压代替平衡浓度计算,分压一总压×物质的量分数,保留三位有效数字)。
,则该温度下反应I的压力平衡常数Kp=_________MPa(用平衡分压代替平衡浓度计算,分压一总压×物质的量分数,保留三位有效数字)。
③若反应在恒温、恒压条件进行,平衡后反应容器的体积_________8.8L(填“>”“<”或“=”)。
④实际生产中发现高于640K后,乙烯和丙烯的产率随温度升高增加幅度减小,可能的原因是__________(任写1条)。
(3)一种丁烷燃料电池工作原理如图所示。

①A电极上发生的是反应_________(填“氧化“或“还原”)。
②写出B电极的电极反应式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com