
��1��ijѧϰС����0.80mol/L��Ũ�ȵ��ռ���Һ�ⶨδ֪Ũ�ȵ����ᡣ
�ٵζ�����ͼ��ʾ���� �ζ���ʢװ��Ũ�ȵ�����������Һ����ס����ҡ�����

���õζ��ķ������ⶨ�����Ũ�ȣ�ʵ������������ʾ��
|
ʵ���� |
����HCl��Һ�����(mL) |
����NaOH��Һ�����(mL) |
|
1 |
20.00 |
23.00 |
|
2 |
20.00 |
23.10 |
|
3 |
20.00 |
22.90 |
��δ֪�����Ũ��Ϊ��������λ��Ч���֣�_______________��
�����в�����ʹ����õ������Ũ��ƫ�͵���__________��
A��ʢװ����Һ����ƿ��ˮϴ��δ����
B���ζ�ǰ����ʽ�ζ��ܼ�������ݣ��ζ���������ʧ
C����ʽ�ζ���������ˮϴ����δ�ñ�����������Һ��ϴ
D������ʽ�ζ��ܵĿ̶�ʱ���ζ�ǰ���Ӱ�Һ����ʹ����ζ����Ӷ���
��2��ij����С��Ϊ�˲ⶨij�Ȼ���(SrCl2)��Ʒ�Ĵ��ȣ���������·�������ȡ1.0 g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO3 2.38 g��AgNO3��Һ(��Һ�г�Cl���⣬����������Ag����Ӧ���ɳ���������)��Cl������ȫ��������Ȼ���ú�Fe3������Һ��ָʾ������0.2 mol��L��1��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag����AgSCN��ɫ��������ʽ�������Բⶨ�Ȼ�����Ʒ�Ĵ��ȡ�
��ش��������⣺
���жϵζ��ﵽ�յ��������_______________________________________________��
�ڿ���Ag����Fe3������������Һ�еĴ�����ʽ����ʵʩ�ζ�����Һ�Գ�_____(ѡ����ԡ��������ԡ����ԡ�)Ϊ�ˡ�
�����յ㵽��֮ǰ�ĵζ������У����ֳ����������������Ag�����費�Ͼ���ҡ����ƿ�������ʹn(Cl��)�IJⶨ���________(ѡ�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
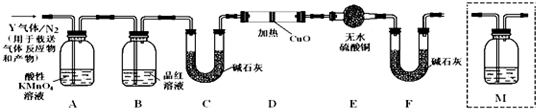
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ��ׯ�и������ϣ����л�ѧ�Ծ��������棩 ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com