
【题目】下列有关物质用途的说法中,不正确的是( )
A. 干冰可用作致冷剂 B. 在铁制容器表面刷铝粉可防止生锈
C. 氢氧化钠可用作医用胃酸中和剂 D. 过氧化钠可用作供氧剂
科目:高中化学 来源: 题型:
【题目】[选修3:物质结构与性质](20分)
Ⅰ(6分)下列叙述正确的有
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性
D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
Ⅱ(14分)ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为___________,原子间存在的共价键类型有________,碳原子的杂化轨道类型为__________________。
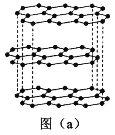


(2)SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______、共价性_________。(填“增强”“不变”或“减弱”)
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_______________;其晶胞参数为1.4 nm,晶体密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(I)随新物质加入量(m)的变化曲线。
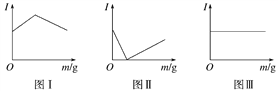
以下4个导电性实验,其中与图Ⅰ、图Ⅱ、图Ⅲ对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量
④NH4Cl溶液中逐渐加入适量NaOH固体
图 选项 | 图Ⅰ | 图Ⅱ | 图Ⅲ |
A | ① | ② | ③ |
B | ④ | ②③ | ① |
C | ③ | ①② | ④ |
D | ② | ①③ | ④ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1024个OH﹣的物质的量为____,质量为___,这些OH﹣与标准状况下__L NH3的物质的量相等,如果这些OH﹣来自2L的Ba(OH)2溶液,则该Ba(OH)2的物质的量浓度为__.
(2)同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的质量之比为___,所含电子数之比为__,相同质量的氨气和硫化氢气体的分子数之比为______密度之比为______.
(3)标况下8.96L 的CH4和CO混合气体,其质量为7.60g,则平均摩尔质量为____________,CH4和CO物质的量之比为________________。
(4)已知100mLAl2(SO4)3溶液中Al3+ 浓度为0.6mol/L,则SO42-的浓度为______________,Al2(SO4)3的物质的量为_____________(不考虑Al3+ 水解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验的基本操作是完成化学实验的关键,下列实验操作正确的是( )
①用50 mL量筒量取5.2 mL稀硫酸; ②用分液漏斗分离苯和四氯化碳的混合物;
③用托盘天平称量117.7 g氯化钠晶体; ④用量筒量取23.10 mL溴水;
⑤用蒸发皿高温灼烧石灰石; ⑥用250 mL容量瓶配制250 mL 0.2 mol·L-1的NaOH溶液;
A. ③⑥ B. ②③④⑤ C. ①②④ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数,下列说法错误的是
为阿伏加德罗常数,下列说法错误的是
A. 1 molH2所含氢气分子数为7![]()
B. 1 molAl与足量的稀盐酸溶液反应生成氢气1.5 mol
C. 在标准状况下,0.5![]() 个Cl2所占的体积约是11.2L
个Cl2所占的体积约是11.2L
D. 在标准状况下,22.4LH2O含有的分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊酸薄荷酯P(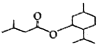 )是一种治疗心脏病的药物。一种制备异戊酸薄荷酯P的流程如下:
)是一种治疗心脏病的药物。一种制备异戊酸薄荷酯P的流程如下:

已知:
RCH=CH2 ![]() RCH2CHBr(R表示烃基)
RCH2CHBr(R表示烃基)
完成下列问题:
(1)A的化学名称为__________。
(2)试剂l的结构简式为__________。
(3)由E生成F的化学方程式为__________;该反应类型是__________。
(4)试剂2可以是__________试剂(填名称或化学式)
(5)由C和H生成P的化学方程式为__________。
(6)H的同分异构体中,能发生水解反应的链状化合物共有_________种(不考虑立体异构);其中核磁共振氢谱有两种峰、且峰值比为9:1的同分异构体的结构简式为__________。
(7)苯乙烯是一种重要的化工原料,参考制备异戊酸薄荷酯中的方法,设计以苯、乙烯为有机原料(无机试剂自选),制备苯乙烯的合成线路:
合成路线常用的表示方法为:![]()
________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的说法中不正确的是 ( )
A. 化学键是一种作用力
B. 化学键可以使原子相结合,也可以使离子相结合
C. 化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成
D. 非极性键不是化学键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com