
����Ŀ��������Ҫ�Ļ���ԭ�ϣ���;�㷺��
��1���ϳɰ��������ô��������ͭ����[Cu��NH3��2]+��CH3COO�����ɣ���Һ���ն��ϳɴ����ж�����CO���壮
�ٴ��������ͭ������Ԫ���У���һ������������ ��
�ڴ��������ͭ����Ԫ�صĵ��ʣ������ľ���������������ţ���
a�����Ӿ��� b�����Ӿ��� c��ԭ�Ӿ��� d����������
�۵�4�����У���̬ԭ�����̬Cuԭ��δ�ɶԵ�����Ŀ��ͬ��Ԫ�����֣�����Cu����
��ͭ����Ϊ�����������壬�侧���߳�a nm����ʽ��ʾͭ���ʵ��ܶ� gcm��3 ��
��2��BF3������NH3������������һ�ְ�ɫ���壺BF3+NH3=F3B��NH3 ��
�پ���F3B��NH3�У�Bԭ�ӵ��ӻ��������Ϊ ��
��д��������BF3������ͬ�ռ乹�͵��������� ��
��3��NH3�����ںϳ����ء�����淋ȵ��ʣ�ij���ʳ���������������м��һ�����ΪN4H4��SO4��2�����ʣ���������ˮ��Һ����SO42����N4H44+�����������幹�͵����Ӵ��ڣ�N4H44+��������һ�����ư���N4���ӣ�
���������˵���У���ȷ����������ţ���
a��N4��N2��ͬ���칹��
b��1mol N4�ֽ�����N2 �� �γ���4mol �м�
c�����ķе��N4�ߣ�����ΪP��P�����ܱ�N��N����
d�����Ļ�ѧ���ʱ�N2���ã�˵��P�ķǽ����Ա�Nǿ
�ڻ���N4H44+�Ľṹ���������е���λ���� ��
���𰸡�
��1������b��c��d��4��![]()
��2��sp3��CO32����NO3��
��3��b��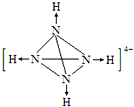
����������1���ٷǽ�����Խǿ����һ������Խ�������������Ų�����ȫ�������״̬ʱ���ȶ�������ʧ���ӣ���һ�����ܽϴ��������ͭ������Ԫ����Cu��O��C��H��N������Nԭ�ӵ�������Ų�Ϊ����״̬����һ�����ܽϴ����Ե�һ������������N�����Դ��ǣ������ڴ��������ͭ����Ԫ����ɵĵ��ʣ���ͭ���ڽ������塢���ʯ����ԭ�Ӿ��塢�������������ڷ��Ӿ��壻���Դ��ǣ�b��c��d����Cu����Χ�����Ų�Ϊ3d104s1 �� ֻ��1��δ�ɶԵ��ӣ���4����Ԫ���У���̬ԭ�Ӻ���һ��δ�ɶԵ��ӵ�Ԫ���У�K��Sc��GaBr������4��Ԫ�أ����Դ��ǣ�4���ܸþ�����ͭԭ�Ӹ���=8�� ![]() +6��
+6�� ![]() =4�������߳�a=a nm=a��10��7cm���������=��a��10��7cm��3 �� �ܶȦ�=
=4�������߳�a=a nm=a��10��7cm���������=��a��10��7cm��3 �� �ܶȦ�= ![]() =
= 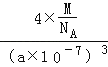 =
= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2���پ���F3B��NH3�У�Bԭ�ӵļ۲���Ӷ���Ϊ4�����ӻ�����Ϊsp3�ӻ��� ���Դ��ǣ�sp3����BF3��B�ļ۲���Ӷ���Ϊ3+
����2���پ���F3B��NH3�У�Bԭ�ӵļ۲���Ӷ���Ϊ4�����ӻ�����Ϊsp3�ӻ��� ���Դ��ǣ�sp3����BF3��B�ļ۲���Ӷ���Ϊ3+ ![]() =3��û�йµ��Ӷԣ����ӵĿռ乹��Ϊ�������Σ�CO32����̼ԭ�Ӽ۲���ӶԸ���=3+
=3��û�йµ��Ӷԣ����ӵĿռ乹��Ϊ�������Σ�CO32����̼ԭ�Ӽ۲���ӶԸ���=3+ ![]() ��4+2��3��2��=3���Ҳ����µ��Ӷԣ�����Cԭ�Ӳ���sp2�ӻ����ռ乹��Ϊƽ�������Σ�NO3�� ��Nԭ���γ�3���Ҽ����¶Ե�����=
��4+2��3��2��=3���Ҳ����µ��Ӷԣ�����Cԭ�Ӳ���sp2�ӻ����ռ乹��Ϊƽ�������Σ�NO3�� ��Nԭ���γ�3���Ҽ����¶Ե�����= ![]() ������ԭ��Ϊsp2�ӻ������幹��Ϊƽ�������Σ����Դ��ǣ�CO32����NO3������3����a������ʽ��ͬ�ṹ��ͬ�Ļ����ﻥ��ͬ���칹�壬N4��N2����NԪ�صĵ��ʣ�����ͬ�������壬��a����
������ԭ��Ϊsp2�ӻ������幹��Ϊƽ�������Σ����Դ��ǣ�CO32����NO3������3����a������ʽ��ͬ�ṹ��ͬ�Ļ����ﻥ��ͬ���칹�壬N4��N2����NԪ�صĵ��ʣ�����ͬ�������壬��a����
b��һ��N2�к���2�� �м���1mol N4 �ֽ�����2molN2 �� �γ���4mol �м�����b��ȷ��
c���ṹ���Ƶķ��Ӿ��壬��Է�����Խ���۷е�Խ�ߣ�������Է�������N4��������أ���c����d��ͬ������ϵ��£��ǽ����Լ�������P�ķǽ����Ա�N�������Ļ�ѧ���ʱ�N2���ã��빲�ۼ��ȶ����йأ���d����
���Դ��ǣ�b��
��N4H44+��ÿ��Nԭ��������3��Nԭ���γɹ��ۼ���ͬʱ��1���������γ���λ������N4H44+�ĽṹͼΪ 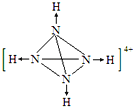 �����Դ��ǣ�
�����Դ��ǣ�  ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��B �� [ʵ�黯ѧ]
1���������һ����Ҫ���л��ϳ��м��壬�е�Ϊ71�棬�ܶ�Ϊ1.36gcm��3 �� ʵ�����Ʊ�����1����������Ҫ�������£�
����1��������A�м��������ӡ�12g��������20mLˮ����ˮ��ȴ�»�������28mLŨH2SO4����ȴ�����£������¼���24g NaBr��
����2����ͼ��ʾ�ʵ��װ�ã��������ȣ�ֱ������״�����Ϊֹ��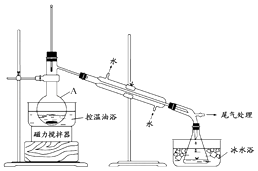
����3�������Һת���Һ©�����ֳ��л��࣮
����4�����ֳ����л���ת���Һ©����������12mL H2O��12mL 5% Na2CO3��Һ��12mL H2Oϴ�ӣ���Һ���ôֲ�Ʒ����һ���ᴿ��1������飮
��1������A�������������������ӵ�Ŀ���ǽ���� ��
��2����Ӧʱ���ɵ���Ҫ�л���������2�������� ��
��3������2���������ƿ�ڼ���������ˮ�����ڱ�ˮԡ�е�Ŀ���� ��
��4������2���軺������ʹ��Ӧ������ƽ�Ƚ��У�Ŀ���� ��
��5������4����5%Na2CO3��Һϴ���л���IJ��������Һ©����С�ļ���12mL 5% Na2CO3��Һ���� �� ���ã���Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܼ��еĵ���ʵ�������е�H+ת�Ƹ��ܼ����ӣ���HCl+H2O=H3O++Cl�� �� ��֪H2SO4��HNO3�ڱ������еĵ���ƽ�ⳣ��Ka1��H2SO4��=6.3��10��9 �� Ka��HNO3��=4.2��10��10 �� ����˵����ȷ���ǣ� ��
A.��������H2SO4�ĵ��뷽��ʽ��H2SO4+2CH3COOH=SO42��+2CH3COOH2+
B.H2SO4�ı�������Һ�У�c��CH3COOH2+��=c��HSO4����+2c��SO42����+c��CH3COO����
C.Ũ�Ⱦ�Ϊ0.1mol?L��1��H2SO4��HNO3�ı�������Һ��pH��H2SO4����pH��HNO3��
D.��HNO3�ı�������Һ�м�������ᣬ ![]() ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A�Ľṹ��ʽ���£�  ������������ȷ���ǣ� ��
������������ȷ���ǣ� ��
A.�л���A���ڷ�����
B.�л���A���Ժ�Br2��CCl4��Һ�����ӳɷ�Ӧ
C.�л���A��Ũ�����ϼ���170��ʱ�����Է�����ȥ��Ӧ
D.1mol A��������NaOH��Һ��Ӧ����������2mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�Ļ�������ϡHNO3�У���Ӧ����ˣ��˳��Ĺ�������Ͷ��������������ų�������Һ��һ�����еĽ�������
A��Cu(NO3)2
B��Fe(NO3)3
C��Fe(NO3)2
D��Fe(NO3)2��Cu(NO3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ1�� 
��1������������������ȷ˳������ӿڴ�����ĸ������E�������������� ��
��2��װ���У�Ũ�������������NaOH��Һ�������� ��
��3����ѧʵ���г���ʪ��ĵ��۩�KI��ֽ�����Ƿ���Cl2�����������Cl2�������ɹ۲쵽
��4��д�����л�ѧ��Ӧ�ķ���ʽ�� �����巢��װ���н��еķ�Ӧ��
��NaOH��Һ�з�����Ӧ�����ӷ���ʽ��
������0.05mol Al3+��Fe3+����Һ�е���1mol/L NaOH��Һ�����ɳ������������NaOH��Һ�������ϵ��ͼ2��ʾ������Һ��Al3+���ʵ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������д������(����)
A. ֻҪ��Һ������Ϳ�������������
B. ����ʱ,Ӧʹ�¶ȼ�ˮ��������������ƿ֧�ܿڴ�
C. ��Һʱ,��Һ©�����²�Һ����¿ڷų�,�ϲ�Һ����Ͽڵ���
D. ����ʱ,�������������ƽ������,�ȼ������������,�������С������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��101kPaʱ��1mol������ȫȼ��ʱ���ų������������������ʵ�ȼ����
B.��ͼ���кͷ�Ӧ����1molˮ����ʱ�ķ�Ӧ�Ƚ��к���
C.ȼ���Ȼ��к��ȶ��Ƿ�Ӧ�ȵ�����֮һ
D.��������һ��ʱ��������������Ӧ����Һ̬ˮ����̬ˮʱ���ų����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������к��й��ۼ������ӻ�������( )
��MgCl2����Na2O2����NaOH����NH4Cl����CO2����H2O2����N2
A. �ڢۢ�B. �٢ڢۢ�C. �٢ڢۢܢ�D. �٢ۢݢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com