
【题目】A、B、C、D、E五种主族元素的原子序教依次增大,且均小于18.A原子的最外层电子比B原子的最外层电子少2个.B 原子的质子数是其电子层数的4倍.A、B、C三种元素能结合成化合物C2AB3 , 在1mol C2AB3中共有52mol电子.D元素的单质0.5mol与酸全部反应时,有9.03×l023个电子转移.E元索的单质是一种黄绿色气体,水溶液具有漂白性. 试填写下列空白:
(1)写出元素A和E的名称:A , E .
(2)元素B在周期表中的位置为第二周期族.
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为化合物(填“离子”或“共价”),写出该化合物的电子式 .
(4)写出C、D两种元素对应的最高价氧化物的水化物相互反应的离子方程式 .
【答案】
(1)碳;氯
(2)VIA
(3)离子;![]()
(4)Al(OH)3+OH﹣=AlO2﹣+2H2O
【解析】解:A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.B原子的质子数是其电子层数的4倍,B为O或Mg,而A原子的最外层电子比B原子的最外层电子少2个,故B只能为O,则A为碳;A、B、C三种元素能结合成化合物C2AB3 , 在1mol C2AB3中共有52mol电子,则C元素原子电子数=(52﹣6﹣24)÷2=11,则C为Na;D元素的单质0.5mol与酸全部反应时,有9.03×1023个即1.5mol电子转移,所以D元素的化合价为+3价,即D为Al;E元素的单质是一种黄绿色气体,水溶液具有漂白性,则E为Cl,.(1)由上述分析可知,A为碳,E为氯,故答案为:碳;氯;(2)B为氧元素,在周期表中的位置为第二周期ⅥA族,故答案为:ⅥA;(3)由元素O、Na形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为Na2O2 , 属于离子化合物,其电子式为 ![]() ,故答案为:离子;
,故答案为:离子; ![]() ;(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应的离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O,故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O. A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.B原子的质子数是其电子层数的4倍,B为O或Mg,而A原子的最外层电子比B原子的最外层电子少2个,故B只能为O,则A为碳;A、B、C三种元素能结合成化合物C2AB3 , 在1mol C2AB3中共有52mol电子,则C元素原子电子数=(52﹣6﹣24)÷2=11,则C为Na;D元素的单质0.5mol与酸全部反应时,有9.03×1023个即1.5mol电子转移,所以D元素的化合价为+3价,即D为Al;E元素的单质是一种黄绿色气体,水溶液具有漂白性,则E为Cl,据此解答.
;(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应的离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O,故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O. A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.B原子的质子数是其电子层数的4倍,B为O或Mg,而A原子的最外层电子比B原子的最外层电子少2个,故B只能为O,则A为碳;A、B、C三种元素能结合成化合物C2AB3 , 在1mol C2AB3中共有52mol电子,则C元素原子电子数=(52﹣6﹣24)÷2=11,则C为Na;D元素的单质0.5mol与酸全部反应时,有9.03×1023个即1.5mol电子转移,所以D元素的化合价为+3价,即D为Al;E元素的单质是一种黄绿色气体,水溶液具有漂白性,则E为Cl,据此解答.


科目:高中化学 来源: 题型:
【题目】X,Y,Z,R为前四周期元素且原子序数依次增大.X的单质与氢气可化合生成气体G,其水溶液pH>7;Y的单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Y,Z分别与钠元素可形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.
请回答下列问题:
(1)M的电子式是;
(2)Y的第一电离能比Z的(填“大”或“小”).R在元素周期表中的位置;Y基态原子的价电子排布图是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合物0.1mol完全燃烧得0.16mol二氧化碳和3.6克水.下列说法正确的是( )
A.一定有甲烷
B.一定是甲烷和乙烯
C.可能有乙烷
D.一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
(1)化合物甲(由氮和另一种常见的主族元素组成)是一种新型无机材料.将8.2g甲溶于足量的氢氧化钠溶液,可产生标准状况下为4.48L的气体,该气体可作制冷剂.向反应后的溶滚中逐滴加入稀盐酸,产生白色沉淀质量最大为15.6g,继续滴加沉淀消失.则甲溶于氢氧化钠的化学方程式为 .
(2)NH3催化还原氮氧化物是目前应用广泛的烟气氮氧化物脱除技术.例如:
4NH3(g)+6NO(g)5N2(g)+6H2O(g)△H1
己知:①H2O(l)=H2O(g)△H2
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3
则NH3(g)的标准燃烧热△H= .
以FeSO4作催化剂在不同温度下,经过相同的时间测试氨还原氮氧化物效果如图1,当反应在400~450℃,NOx的转化率随温度升高而降低.当体系温度升至500℃以上时.NOx的转化率迅速下降,其可能原因是 . 图2反映的是在400℃N2的体积分数与反应物中 ![]() 的关系,请在下面的图2上画出450℃的变化趋势曲线 .
的关系,请在下面的图2上画出450℃的变化趋势曲线 .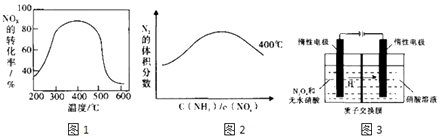
(3)N2O5是绿色硝化试剂,溶于水可得硝酸.图3是以N2O4为原料电解制备N2O5的装置示意图.写出阳极区生成N2O5的电极反应式是 .
(4)常温下,向0.1mol/L氨水中加入少许N2O5 , 使溶液中c(NH3H2O):c(NH4+)=5:9,此时溶液的pH= . (25℃时.NH3H2O的电离平衡常数Kb=1.8×10﹣5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸(CH2 = CH — COOH)的性质可能有 ( )
① 加成反应 ② 取代反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应
A. 只有①③B. 只有①③④C. 只有①③④⑤D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是( ) 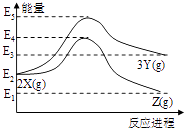
A.由X→Y反应的△H=E5﹣E2
B.由X→Z反应的△H>0
C.由图可知等物质的量的Y的能量一定比X的能量高
D.升高温度可提高X→Z的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并写出该反应属于何种反应类型.
(1)乙烯使溴水退色
(2)苯与浓硫酸和浓硝酸的混合液共热
(3)由氯乙烯制聚氯乙烯
(4)甲苯与浓硝酸、浓硫酸混合制TNT
(5)苯乙烯与足量氢气反应 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH2Cl2不存在同分异构体是甲烷正四面体结构的理由之一
B.![]() 和
和 ![]() 互为同系物
互为同系物
C.![]() 的系统命名的名称是1,2﹣二溴﹣2﹣环己烯
的系统命名的名称是1,2﹣二溴﹣2﹣环己烯
D.![]() 的名称为2﹣甲基﹣3﹣乙基丁烷
的名称为2﹣甲基﹣3﹣乙基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10﹣10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
﹣2 | ﹣3 | ﹣1 | ﹣3 |
回答下列问题:
(1)①在元素周期表中的位置是(周期、族) .
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是;碱性最强的化合物的电子式是: .
(3)比较④和⑦的氢化物的稳定性(用化学式表示) .
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式: .
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com