
科目:高中化学 来源: 题型:
| 葡萄糖注射液 |
| 规格:250mL |
| 密度:1.08g?mL-1 |
| 生产批号:10032032 |
| 有效期:至2013年3月 |
| 质量分数:5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
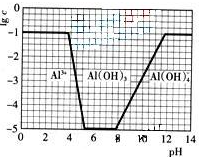 (2009?广东)超细氧化铝是一种重要的功能陶瓷原料.
(2009?广东)超细氧化铝是一种重要的功能陶瓷原料. Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑ Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com