
【题目】用石墨做电极电解CuSO4溶液。通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的( )
A. CuSO4B. H2OC. CuOD. Cu(OH)2
【答案】C
【解析】
用铂电极电解CuSO4溶液,阴极铜离子放电,阳极氢氧根离子放电,然后根据析出的物质向溶液中加入它们形成的化合物即可。
CuSO4溶液存在的阴离子为:SO42-、OH-,OH-离子的放电能力大于SO42- 离子的放电能力,所以OH-离子放电生成氧气;
溶液中存在的阳离子是Cu2+、H+,Cu2+离子的放电能力大于H+离子的放电能力,所以Cu2+离子放电生成Cu;
溶液变成硫酸溶液;
电解硫酸铜的方程式为:2CuSO4+2H2O![]() 2 Cu+O2 ↑+2H2SO4,
2 Cu+O2 ↑+2H2SO4,
从溶液中析出的物质是氧气和铜,因为氧气和铜和稀硫酸都不反应,但和氧化铜反应,氧气和铜反应生成氧化铜,所以向溶液中加入氧化铜即可,
故选:C。


科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是

A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钾是一种无色晶体,易溶于水。实验室制备KI晶体的步骤如下:
Ⅰ.在如下图所示的三颈烧瓶中加入研细的I2和一定量的30%KOH溶液,搅拌(已知:I2与KOH反应产物之一是KIO3);
Ⅱ.碘完全反应后,打开分液漏斗中的活塞、弹簧夹1、2,向装置C中通入足量的H2S;
Ⅲ.反应结束后,向装置C中加入稀H2SO4酸化,水浴加热;
Ⅳ.冷却,过滤得KI粗溶液。
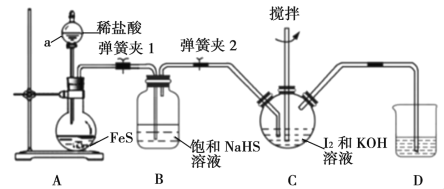
(1)仪器a的名称是__________,步骤Ⅰ中控制KOH溶液过量的目的是______________。
(2)装置B的作用是_____________,装置D中盛放的溶液是________________。
(3)装置C中H2S和KIO3反应的离子方程式为_______________________。
(4)步骤Ⅲ中水浴加热的目的是除去_________________________(填化学式)。
(5)由步骤Ⅳ所得的KI粗溶液中含有少量K2SO4,需进行提纯,提纯流程如下:
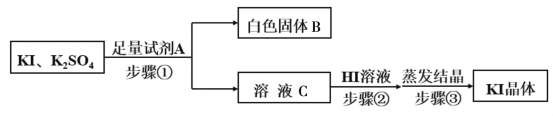
①已知白色固体B是混合物,试剂A为__________,为除去溶液C中的杂质,步骤②中调节溶液为弱酸性,则加入HI溶液后产生的现象是___________________。
②为测定最后所得KI晶体的纯度,取a g晶体配制100mL溶液,取出25mL溶液,滴入足量稀的酸性K2Cr2O7溶液,充分反应后,滴加几滴淀粉溶液为指示剂,用b mol·L-1的Na2S2O3溶液进行滴定,消耗Na2S2O3溶液VmL。
滴定过程中涉及的反应为:![]() ,
,![]() 则滴定终点时的现象为________________________,晶体的纯度为_______________________(列出计算式)。
则滴定终点时的现象为________________________,晶体的纯度为_______________________(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是___,氧化产物是___(填写化学式)。
(2)根据上述反应,鉴别NaNO2、NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有______(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______(填编号)。
A.NaClB.NH4ClC.HNO3D.浓H2SO4
(4)化学方程式:10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.若反应过程中转移5mole-,则生成标准状况下N2的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
(1)能说明该反应已达到平衡状态的标志是___(填字母序号)
a.反应速率4v正(NH3)=5v逆(N2)
b.单位时间里每生成5mol N2,同时生成4mol NH3
c.容器内压强不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
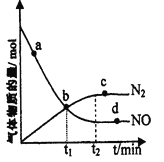
(2)某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为____(选填字母)。
(3)一定条件下,在2L密闭容器内,反应2NO2![]() N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均反应速率____。在第5s时,NO2的转化率为____。根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭可处理大气污染物NO。为模拟该过程,T℃时,在3L密闭容器中加入NO和活性炭粉,反应体系中各物质的量变化如下表所示。下列说法正确的是
活性炭/mol | NO/mol | X/mol | Y/mol | |
起始时 | 2.030 | 0.100 | 0 | 0 |
10min达平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
A. X一定是N2,Y一定是CO2
B. 10min后增大压强,NO的吸收率增大
C. 10min后加入活性炭,平衡向正反应方向移动
D. 0~10min的平均反应速率v(NO)=0.002 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:
KIO3+ KI+ H2SO4═ K2SO4+ I2 + H2O
(1)配平该方程式,并且用双线桥法表示该方程式电子转移的方向与数目:____________________
(2)该反应中氧化剂和还原剂的物质的量之比为______________;
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe都是重要的金属元素。下列说法正确的是
A.氧化物都是碱性氧化物
B.氢氧化物都是白色固体
C.单质都可以与水反应
D.单质在空气中都形成致密氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
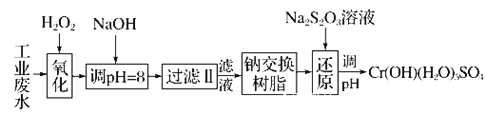
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化过程中可代替H2O2加入的试剂是________(填字母,下同)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;
已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是____________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水,该法用Fe作电极电解含Cr2O
的废水,该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是_____________。
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-20,假设溶液的c(Cr3+)=0.01mol/L,当pH应为______时开始生成沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com