
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是___,氧化产物是___(填写化学式)。
(2)根据上述反应,鉴别NaNO2、NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有______(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______(填编号)。
A.NaClB.NH4ClC.HNO3D.浓H2SO4
(4)化学方程式:10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.若反应过程中转移5mole-,则生成标准状况下N2的体积为______L。
【答案】NaNO2 I2 ②⑤ B 11.2
【解析】
(1)氧化还原反应中,化合价降低元素所在的反应物是氧化剂;
(2)根据反应时有沉淀、气体、颜色变化等明显现象选择试剂;
(3)选择试剂时要考虑:既能使NaNO2转化又无二次污染;
(4)反应中Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为0,由电子守恒分析。
(1)2NaNO2+4HI═2NO+I2+2NaI+2H2O,氮元素的化合价降低,则NaNO2是氧化剂;I元素化合价从-1价升高为0价,则氧化产物为I2;
(2)①水、③淀粉、④白酒与NaNO2都不反应,所以无明显现象;KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,故答案为:②⑤;
(3)NaNO2→N2是被还原,必须加还原剂;N元素非金属性弱于O和Cl元素,故只能加NH4Cl作还原剂.方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,故答案为:B;
(4)在反应10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O中溶解10molAl转移30mol电子,同时生成3molN2,则过程中转移5mole-,则生成标准状况下N2的体积为5mol×![]() ×22.4L/mol=11.2L。
×22.4L/mol=11.2L。


科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成离子化合物,其阴阳离子个数比为1∶1。回答下列问题:
(1)五种元素中非金属性最强的是____(填元素符号)。
(2)由A和B、D、E所形成的共价化合物中,热稳定性最差的是___(用化学式表示)。
(3)C和E形成的离子化合物的电子式为 __,用电子式表示A和B形成的过程___,A和E形成的化合物与A和B形成的化合物反应,产物的化学式___
(4)D的最高价氧化物的水化物的化学式为____。
(5)由A和B形成的一种气体在工业上用途很广,实验室制取的方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下废液中NH4+能转化为N2(g)和H2O(l),示意图如下:
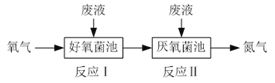
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH1=a kJ·mol-1
反应II:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是
A. 两池发生的反应中氮元素只被氧化
B. 两池中投放的废液体积相等时NH4+能完全转化为N2
C. 常温常压下,反应II中生成22.4 L N2转移的电子数为3.75×6.02×1023
D. 4NH4+(aq)+3O2(g)=2N2(g)+4H+(aq)+6H2O(l) ΔH=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的图示与对应的叙述相符的是( )
A.如图表示向A1Cl3溶液中滴加NaOH溶液时n [Al(OH)3]的变化情况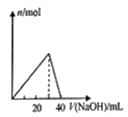
B.如图表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
C.如图表示某一放热反应,若使用催化剂,E1、E2、△H都会发生改变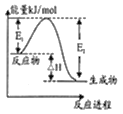
D.如图表示向Na2CO3溶液中滴加稀盐酸时,产生n (CO2)的情况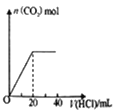
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
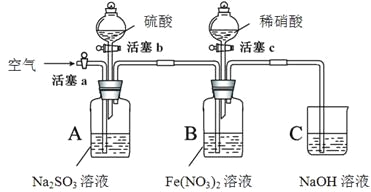
实验记录如下:
实验操作 | 实验现象 | |
I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
V | 打开活塞a,通入一段时间空气 | ———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2++ NO![]() [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨做电极电解CuSO4溶液。通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的( )
A. CuSO4B. H2OC. CuOD. Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol NH4+质量为_____,其中含质子、电子的数目分别为_____、_____。
(2)标准状态下,672mL某气体质量为0.84g,该气体摩尔质量为_____。
CO 和CO2 混合气体的密度相对氢气为19,则CO 和CO2体积比为_________,若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是____________g;将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸的物质的量浓度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)(1)能证明亚硫酸钠中部分变质所需要的试剂是(______)
A.硝酸钡,稀硫酸 B.稀盐酸,氯化钡
C.稀硫酸,氯化钡 D.稀硝酸,氯化钡
(2)烟气中的NO2与尿素[CO(NH2)2](C的化合价为+4)反应进行脱硝。反应的化学方程式是2CO(NH2)2+4NO2→4H2O +2CO2+4N2+O2。该反应的氧化产物为___;若反应过程中有0.15molNO2反应,则电子转移的数目为___。
(二)某实验小组同学为了探究铜与浓硫酸的反应,进行了一系列实验。在反应过程中会发生一些副反应,生成不溶于水和酸的CuS、Cu2S。
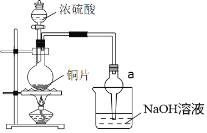
(1)出于安全和绿色化学考虑,在制取硫酸铜时,可选用下列的物质是___。
a.Cu b.CuO c.CuS d.CuSO4·Cu(OH)2·H2O
(2)装置a的作用是___。反应过程中,因为浓硫酸的吸水作用,烧瓶中出现白色固体物质,如何简便检验反应后圆底烧瓶里有Cu2+存在?___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com