
【题目】(1)1mol NH4+质量为_____,其中含质子、电子的数目分别为_____、_____。
(2)标准状态下,672mL某气体质量为0.84g,该气体摩尔质量为_____。
CO 和CO2 混合气体的密度相对氢气为19,则CO 和CO2体积比为_________,若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是____________g;将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸的物质的量浓度是___________。
【答案】 18g 11NA 10NA 28g /mol 3:5 M/NA 1000ab/22400+36.5a
【解析】(1)1mol NH4+质量为1mol×18g/mol=18g,其中含质子、电子的数目分别为11NA、10NA;(2)标准状态下,672mL某气体质量为0.84g,物质的量是0.672L÷22.4L/mol=0.03mol,该气体的摩尔质量为0.84g÷0.03mol=28g/mol;CO和CO2混合气体的密度相对氢气为19,则混合气体的平均相对分子质量是38,根据十字交叉法可知CO和CO2体积比为![]() ;若某原子的摩尔质量是M g/mol,即1mol该原子的质量是M g,则一个该原子的真实质量是M/NA g;将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,氯化氢的物质的量是
;若某原子的摩尔质量是M g/mol,即1mol该原子的质量是M g,则一个该原子的真实质量是M/NA g;将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,氯化氢的物质的量是![]() ,质量是
,质量是![]() ,溶液体积是
,溶液体积是![]() ,则该盐酸的物质的量浓度是
,则该盐酸的物质的量浓度是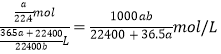 。
。


科目:高中化学 来源: 题型:
【题目】由硫酸钾、硫酸铝和硫酸组成的混合溶液中,c(H+)=0.2molL-1,c(Al3+)=0.4molL-1,c(SO42-)=0.8molL-1,则c(K+)为( )
A. 0.2molL-1 B. 0.3molL-1 C. 0.4molL-1 D. 0.5molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应有广泛的用途,实验装置如下图所示。
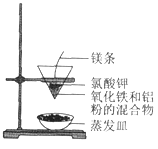
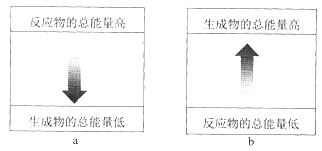
(1)铝热反应是 __________________(填“吸热”或“放热”)反应,其能量变化可用下图中的 ___________________(填序号)表示。
(2)该铝热反应的化学方程式是____________________________________。
(3)任写出铝热反应在实际生产中的一种用途____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“西气东输”是西部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷.工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2 , 两者的体积比约为1:1.已知1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成液态水放出286kJ热量;1molCH4 气体完全燃烧生成CO2气体和液态水放出890kJ热量.
(1)写出H2完全燃烧生成液态水的热化学反应方程式: , 若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出的热量 890kJ(填“>”、“=”或“<”)
(2)忽略水煤气中其它成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为;燃烧生成的CO2 的质量比约为 .
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A (g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如图所示.下列说法中正确是( ) 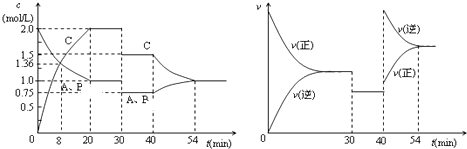
A.8min前A的平均反应速率为0.08mol/(Ls)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 = akJ/mol;
CO(g) + H2O (g)=CO2(g) + H2 (g) △H2 = bkJ/mol;
2CO(g) + O2(g)= 2CO2(g) △H3 = ckJ/mol;
反应CO2(g)+ CH4(g)=2CO(g) + 2H2(g) 的△H = _____kJ/mol;
(2) 科学家用氮化镓材料与铜组装如图10的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
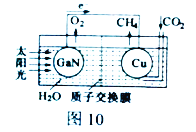
①写出铜电极表面的电极反应式_____________。
②为提高该人工光合系统的工作效率,可向装置中加入少量_______ (选填“盐酸”或“硫酸”)。
(3) 天然气中的H2S 杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________。
(4) 将甲烷和硫反应可以制备CS2,其流程如图11所示:
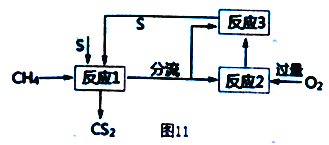
①写出发生反应1的化学反应方程式___________。
②反应1产生两种含硫的物质,为了提高CS2的产率,设计反应2和3实现硫单质循环利用,实验时需对反应1出来的气体分流,则进入反应2 和反应3 的气体物质的量之比为___________。
③当反应1中每有1molCS2生成时,反应2中需要消耗O2的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( ) 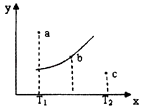
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4
B.澄清的石灰水与盐酸反应:H++OH-=H2O
C.碳酸钡加入稀硫酸:BaCO3+2H+=Ba2++H2O+CO2↑
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com