
【题目】(1) 已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 = akJ/mol;
CO(g) + H2O (g)=CO2(g) + H2 (g) △H2 = bkJ/mol;
2CO(g) + O2(g)= 2CO2(g) △H3 = ckJ/mol;
反应CO2(g)+ CH4(g)=2CO(g) + 2H2(g) 的△H = _____kJ/mol;
(2) 科学家用氮化镓材料与铜组装如图10的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
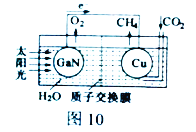
①写出铜电极表面的电极反应式_____________。
②为提高该人工光合系统的工作效率,可向装置中加入少量_______ (选填“盐酸”或“硫酸”)。
(3) 天然气中的H2S 杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________。
(4) 将甲烷和硫反应可以制备CS2,其流程如图11所示:
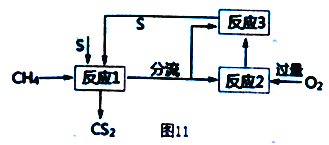
①写出发生反应1的化学反应方程式___________。
②反应1产生两种含硫的物质,为了提高CS2的产率,设计反应2和3实现硫单质循环利用,实验时需对反应1出来的气体分流,则进入反应2 和反应3 的气体物质的量之比为___________。
③当反应1中每有1molCS2生成时,反应2中需要消耗O2的物质的量为___________。
【答案】 a+2b-2c CO2+8e-+8H+=CH4+2H2O 硫酸 2NH4HS+O2=2S↓+2NH3·H2O CH4+4S=CS2+2H2S 1:2 1mol
【解析】试题分析:本题考查盖斯定律的应用,电极反应式的书写,指定情境下方程式的书写,含S化合物之间的转化,物质的量应用于化学方程式的计算。
(1)将反应编号,CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=akJ/mol(①式)
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=bkJ/mol(②式)
2CO(g)+O2(g)=2CO2(g) △H3=ckJ/mol(③式)
应用盖斯定律,将①式+②式![]() 2-③式
2-③式![]() 2,得CO2(g)+CH4(g)=2CO(g)+2H2(g)△H=(a+2b-2c)kJ/mol。
2,得CO2(g)+CH4(g)=2CO(g)+2H2(g)△H=(a+2b-2c)kJ/mol。
(2)①根据装置图中电子的流向和物质的流向,Cu电极表面上CO2得电子被还原成CH4,CO2中C元素的化合价为+4价,CH4中C元素的化合价为-4价,1molCO2得8mol电子生成1molCH4,结合质子交换膜,Cu电极表面的电极反应式为:CO2+8e-+8H+=CH4+2H2O。
②GaN材料上的电极反应式为:4OH--4e-=O2↑+2H2O。为提高该人工光合系统的工作效率,可向装置中加入少量硫酸,不能加入盐酸,若加入盐酸,放电能力:Cl-![]() OH-,GaN表面Cl-优先放电产生Cl2。
OH-,GaN表面Cl-优先放电产生Cl2。
(3)根据题意,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,即NH4HS溶液与空气作用生成S和氨水,再生反应的化学方程式为:2NH4HS+O2=2S↓+2NH3·H2O。
(4)由流程知,反应1的反应物为CH4和S,反应1产生两种含硫的物质,生成物为CS2和H2S;生成的H2S一部分与过量O2作用发生反应2生成SO2,反应2生成的SO2与另一部分H2S发生反应3生成S,S循环利用。
①反应1的化学方程式为:CH4+4S=CS2+2H2S。
②反应2的化学方程式为:2H2S+3O2=2SO2+2H2O;反应3的化学方程式为:2H2S+SO2=3S↓+2H2O;为了充分利用S,进入反应2和反应3的气体物质的量之比为1:2。
③根据反应,反应1中每有1molCS2生成,同时生成2molH2S,2molH2S中进入反应2的为2mol![]() =
=![]() mol,则反应2消耗的O2为
mol,则反应2消耗的O2为![]() n(H2S)=1mol。
n(H2S)=1mol。


科目:高中化学 来源: 题型:
【题目】(1)1mol NH4+质量为_____,其中含质子、电子的数目分别为_____、_____。
(2)标准状态下,672mL某气体质量为0.84g,该气体摩尔质量为_____。
CO 和CO2 混合气体的密度相对氢气为19,则CO 和CO2体积比为_________,若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是____________g;将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸的物质的量浓度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3) 是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1) 工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3 ↓+ (NH4)2SO4+CO2 ↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是_____。
(2) 实验室模拟工业二氧化锰制备硫酸锰装置如图4所示。

①石灰乳的作用是________。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有________。
(3) MnCO3 在空气中加热易转化为不同价态的锰的氧化物,且其固体残留率随温度的变化如图5 中A、B、C、D 点所示。则300℃时,剩余固体中锰元素与氧元素的物质的量之比即n(Mn) :n(O)为_______; 图中点D 对应固体的成分为______ (填化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知离子的氧化性:Fe3+>SO![]() ,离子的还原性:S2->I->Fe2+,向FeCl3溶液中加入下列物质,溶液颜色不是因发生化学变化而改变的是( )
,离子的还原性:S2->I->Fe2+,向FeCl3溶液中加入下列物质,溶液颜色不是因发生化学变化而改变的是( )
A. SO2 B. Na2S C. KI D. CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式__________________________________________
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应。氧化产物为__________
(3)当0.1 mol MnO2参加反应时,转移电子数为____,被氧化的HCl为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com