
【题目】(一)(1)能证明亚硫酸钠中部分变质所需要的试剂是(______)
A.硝酸钡,稀硫酸 B.稀盐酸,氯化钡
C.稀硫酸,氯化钡 D.稀硝酸,氯化钡
(2)烟气中的NO2与尿素[CO(NH2)2](C的化合价为+4)反应进行脱硝。反应的化学方程式是2CO(NH2)2+4NO2→4H2O +2CO2+4N2+O2。该反应的氧化产物为___;若反应过程中有0.15molNO2反应,则电子转移的数目为___。
(二)某实验小组同学为了探究铜与浓硫酸的反应,进行了一系列实验。在反应过程中会发生一些副反应,生成不溶于水和酸的CuS、Cu2S。
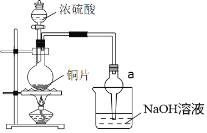
(1)出于安全和绿色化学考虑,在制取硫酸铜时,可选用下列的物质是___。
a.Cu b.CuO c.CuS d.CuSO4·Cu(OH)2·H2O
(2)装置a的作用是___。反应过程中,因为浓硫酸的吸水作用,烧瓶中出现白色固体物质,如何简便检验反应后圆底烧瓶里有Cu2+存在?___。
【答案】B N2和O2 0.6NA bd 防倒吸 将反应后的溶液沿烧杯壁缓缓倒入水中,若溶液变蓝,则有Cu2+存在
【解析】
(一)(1)亚硫酸钠具有还原性,证明亚硫酸钠中部分变质,即证明含有硫酸根离子;
(2)CO(NH2)2中氮元素化合价由-3升高为0,NO2中氮元素化合价由+4降低为0,氧元素化合价由-2升高为0。
(二)(1)出于安全和绿色化学考虑,不能生成有毒气体;
(2)二氧化硫易溶于氢氧化钠溶液,需要防止倒吸。含有Cu2+的稀溶液呈蓝色,可将反应后的溶液稀释,观察是否变蓝;
(一)(1)硫酸钡、亚硫酸钡都难溶于水,证明亚硫酸钠中含有硫酸钠,先加酸排除亚硫酸根离子的干扰,再加氯化钡,若有白色沉淀生成,则说明含有硫酸根离子;稀硝酸能把亚硫酸根离子氧化为硫酸根离子,不能用硝酸,所以选B;
(2)2CO(NH2)2+4NO2→4H2O +2CO2+4N2+O2,CO(NH2)2中氮元素化合价由-3升高为0,NO2中氮元素化合价由+4降低为0,氧元素化合价由-2升高为0,该反应的氧化产物为N2和O2;根据方程式4molNO2反应转移16mol电子,若0.15molNO2反应,转移0.6mol电子,转移电子数为0.6NA;
(二)(1)a.Cu与浓硫酸反应放出污染性气体二氧化硫,故不选a;
b.CuO与硫酸反应生成硫酸铜和水,不生成有毒气体,故选b;
c.CuS与硫酸反应能生成有毒气体硫化氢,故不选c;
d.CuSO4·Cu(OH)2·H2O与硫酸反应生成硫酸铜和水,不生成有毒气体,故选d;
(2)二氧化硫易溶于氢氧化钠溶液,需要防止倒吸,装置a的作用是防倒吸。含有Cu2+的稀溶液呈蓝色,将反应后的溶液沿烧杯壁缓缓倒入水中,若溶液变蓝,则有Cu2+存在;


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是___,氧化产物是___(填写化学式)。
(2)根据上述反应,鉴别NaNO2、NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有______(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______(填编号)。
A.NaClB.NH4ClC.HNO3D.浓H2SO4
(4)化学方程式:10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.若反应过程中转移5mole-,则生成标准状况下N2的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe都是重要的金属元素。下列说法正确的是
A.氧化物都是碱性氧化物
B.氢氧化物都是白色固体
C.单质都可以与水反应
D.单质在空气中都形成致密氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. CS2为V形的极性分子,形成分子晶体
B. ClO3-的空间构型为平面三角形
C. 氯化硼BCl3的熔点为-107 ℃,氯化硼液态时能导电而固态时不导电
D. SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是第三周期元素,它们最高价氧化物对应的水化物溶于水,得到浓度均为0.010mol/L的溶液,其pH(25℃)与对应元素原子半径的关系如图所示。下列说法正确的是( )

A. 简单离子的半径:X>Z>W
B. 简单气态氢化物的稳定性:Z>W>Y
C. Y单质可用于制作半导体材料
D. n =2-lg2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3 与NaHCO3的性质判断正确的是![]()
![]()
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度盐酸反应的剧烈程度:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
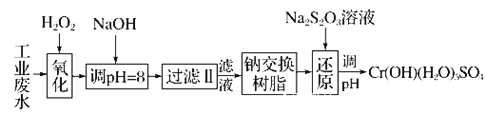
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化过程中可代替H2O2加入的试剂是________(填字母,下同)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;
已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是____________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水,该法用Fe作电极电解含Cr2O
的废水,该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是_____________。
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-20,假设溶液的c(Cr3+)=0.01mol/L,当pH应为______时开始生成沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
① | ② | ③ | II中实验现象 |
| |
A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色变为浅红色 | |
B | 浓氨水 | 氧化钙 | 硫酸亚铁溶液 | 产生大量白色沉淀 | |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
D | NH4Cl溶液 | NaAlO2溶液 | 紫色石蕊试液 | 溶液由紫色变为蓝色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成某药物中间体Z的方法如下。下列说法正确的是
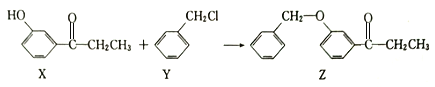
A. 1molX最多能消耗溴水中的2molBr2 B. Y可以发生消去反应
C. Z中所有碳原子可以在同一平面 D. 用FeCl3溶液可以检验Z中是否混有X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com