
����Ŀ��ijС��ͬѧΪ�Ƚ�����������NO3����SO42����Fe3+��������ǿ�����������ʵ�飨�г���������ȥ��װ�õ��������Ѽ��飩��
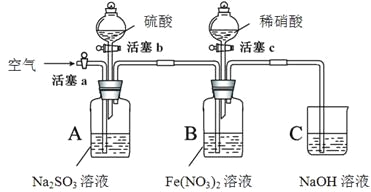
ʵ���¼���£�
ʵ����� | ʵ������ | |
I | ����c��������ϡHNO3����װ��B�У��رջ���c | B��dz��ɫ��Һ������Ϊ����ɫ��һ��ʱ�����Һ���ձ�Ϊ��ɫ�� |
II | ��ע����ȡ������Bװ���е���Һ������KSCN��Һ | ��Һ��Ϊ��ɫ�� |
III | ����b����Aװ���м����������ᣬ�رջ���b | A�в������壻B�������ݣ�Һ��������������ɫ�������ɡ� |
IV | һ��ʱ�����ע����ȡ������Bװ���е���Һ������ | ���� |
V | ����a��ͨ��һ��ʱ����� | �������� |
��ش��������⣺
��1������Fe(NO3)2��Һʱ�����������ۣ�Ŀ���ǣ��û�ѧ����ʽ��ʾ��________��
��2��ʵ��I�У�������Ӧ�����ӷ���ʽ��________��
��3�����ϱ�����Fe2+����NO����γ�����ɫ����[Fe(NO)]2+�� Fe2++ NO![]() [Fe(NO)]2+
[Fe(NO)]2+
��ƽ���ƶ�ԭ������ʵ��I����Һ������ɫ��Ϊ��ɫ��ԭ����________________________��
��4������ʵ������ͬѧ�ǵó��˽��ۡ���
�� ʵ��IV�ĺ���������________________���۲쵽��������________________��
�� ��ʵ��ó��Ľ�����_______________________��
��5��ʵ�鷴˼
�� ʵ�����V��Ŀ����_______________________________________��
�� ʵ�����III����ʼʱB����Һ����ɫ�������Ա仯����ʱ��Һ�з�����Ӧ�����ӷ���ʽ��________��
�� ��ͬѧ��Ϊװ���еĿ��������ʵ����۵ĵó���Ӧ��ʵ��ǰͨһ��ʱ��ĵ��������Ƿ�ͬ��ÿ�����������________________________________________��
���𰸡���1��2Fe(NO3)3+ Fe = 3Fe(NO3)2
��2��3Fe2++ NO3��+ 4H+= 3Fe3++ NO��+ 2H2O
��3��Fe2+��ϡ��������ΪFe3+��ʹ��Һ��c(Fe2+)���½���ͬʱNO�����ݳ���Ҳʹ��Һ��c(NO)���½�����ƽ��Fe2++ NO![]() [Fe(NO)]2+���ƣ���Һ��ɫ��ȥ����ʾ��Fe3+�Ļ�ɫ��
[Fe(NO)]2+���ƣ���Һ��ɫ��ȥ����ʾ��Fe3+�Ļ�ɫ��
��4���� ����K3[Fe(CN)6]��Һ ������ɫ����
�� �����ԣ�NO3����Fe3+��SO42��
��5���� ��װ���е�SO2��NO��NO2�������Ž�NaOH��Һ�����գ���ֹ��Ⱦ����
�� 3SO2+ 2NO3��+ 2H2O = 3SO42��+ 2NO+ 4H+
�� ��ͬ�⣬
a.ʵ��I����Һ����ɫ����NO���ɣ�˵����������Fe2+��������NO3����Fe3+��
b.ʵ��IV����Һ�м��Fe2+��˵����������ԭ��Fe3+��������Fe3+��SO42����
��װ�����Ƿ��������ء�
��������
�����Fe(NO3)2��Һ����������ԭ��Ӧ��Fe2+������ΪFe3+�����ᱻ��ԭΪNO�����ɵ�NO�ͻ�û��Ӧ��Fe2+Ѹ�ٷ�Ӧ��������ɫ����[Fe(NO)]2+������Fe2+���ϱ���������Ũ�����ͣ�ʹƽ��Fe2++ NO![]() [Fe(NO)]2+���ƣ���Һ��ɫ��ȥ����ʾ��Fe3+�Ļ�ɫ������KSCN��Һ���Ժ�ɫ���������Fe(NO3)2�ķ�Ӧ�У���������������Fe3+������������������������ǿ��Fe3+��װ��A������SO2����B�У���B�е�Fe3+������Ӧ��SO2+2Fe3++2H2O=2Fe2++SO42-+4H+��Fe3+����������SO42-�������������Fe3+��������ǿ��SO42-���Ӷ����Եó�����������NO3����SO42����Fe3+��������ǿ����
[Fe(NO)]2+���ƣ���Һ��ɫ��ȥ����ʾ��Fe3+�Ļ�ɫ������KSCN��Һ���Ժ�ɫ���������Fe(NO3)2�ķ�Ӧ�У���������������Fe3+������������������������ǿ��Fe3+��װ��A������SO2����B�У���B�е�Fe3+������Ӧ��SO2+2Fe3++2H2O=2Fe2++SO42-+4H+��Fe3+����������SO42-�������������Fe3+��������ǿ��SO42-���Ӷ����Եó�����������NO3����SO42����Fe3+��������ǿ����
��1���������۵�Ŀ����Ϊ�˷�ֹ�������ӱ���������ѧ����ʽΪ��2Fe(NO3)3+ Fe = 3Fe(NO3)2��
��2��ʵ��I�У�Fe2+��ϡ��������ΪFe3+�����ӷ���ʽΪ��3Fe2++ NO3��+ 4H+= 3Fe3++ NO��+ 2H2O��
��3�������Fe(NO3)2��Һ����������ԭ��Ӧ��Fe2+������ΪFe3+�����ᱻ��ԭΪNO�����ɵ�NO�ͻ�û��Ӧ��Fe2+Ѹ�ٷ�Ӧ��������ɫ����[Fe(NO)]2+������Fe2+���ϱ�������ͬʱNO�����ݳ���Ҳʹ��Һ��c(NO)���½�������Ũ�����ͣ�ʹƽ��Fe2++ NO![]() [Fe(NO)]2+���ƣ���Һ��ɫ��ȥ����ʾ��Fe3+�Ļ�ɫ��
[Fe(NO)]2+���ƣ���Һ��ɫ��ȥ����ʾ��Fe3+�Ļ�ɫ��
��4��ʵ��IV�Ǽ���B�з�Ӧ�����Һ���Ƿ����Fe2+��������Fe2+����֤��SO2��Fe3+�����˷�ӦSO2+2Fe3++2H2O=2Fe2++SO42-+4H+��˵��Fe3+��������ǿ��SO42-�����ʵ���͢��Եó������ԣ�NO3����Fe3+��SO42���Ľ��ۡ�����ʵ����ĺ���ʵ������Ǽ���K3[Fe(CN)6]��Һ��������ɫ�������ʴ�Ϊ������K3[Fe(CN)6]��Һ��������ɫ�����������ԣ�NO3����Fe3+��SO42����
��5������ͨ�������Ϊ�˽�װ���е�SO2��NO��NO2�������Ž�NaOH��Һ�����գ���ֹ��Ⱦ����������ʵ�����������˹��������ᣬ����ʵ�����III��ʼʱͨ���SO2��B�е����ᷢ��������ԭ��Ӧ������NO��SO42-����Һ����ɫ�������Ա仯��������Ӧ�����ӷ���ʽ�ǣ�3SO2+ 2NO3��+ 2H2O = 3SO42��+ 2NO+ 4H+��װ�����Ƿ�����������ʵ����۵ĵó�û��Ӱ�졣��Ϊʵ��I����Һ����ɫ����NO���ɣ�˵����������Fe2+��������NO3����Fe3+��ʵ��IV����Һ�м��Fe2+��˵����������ԭ��Fe3+��������Fe3+��SO42������װ�����Ƿ��������ء��ʴ�Ϊ���ٽ�װ���е�SO2��NO��NO2�������Ž�NaOH��Һ�����գ���ֹ��Ⱦ��������3SO2+ 2NO3��+ 2H2O = 3SO42��+ 2NO��+ 4H+���� ��ͬ�⡣a.ʵ��I����Һ����ɫ����NO���ɣ�˵����������Fe2+��������NO3����Fe3+��b.ʵ��IV����Һ�м��Fe2+��˵����������ԭ��Fe3+��������Fe3+��SO42������װ�����Ƿ��������ء�


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת���ڸ�����������ʵ�ֵ��ǣ� ��
��![]()
��![]()
�۱���NaCl��aq��![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
��![]() ��ˮFeCl3
��ˮFeCl3
��MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A.�٢ۢ�B.�ڢۢ�C.�ڢܢ�D.�٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�� ��Ҫ��д�����з�Ӧ�ķ���ʽ��
�ٴ�����뷽��ʽ��______________��
��һˮ�ϰ����뷽��ʽ��_______________________��
��̼���������������Ʒ�Ӧ���ӷ���ʽ��___________��
��2�� ��0.2 L��NaCl��MgCl2��CaCl2��ɵĻ��Һ�У���������Ũ�ȴ�С����ͼ��ʾ���ش��������⣺
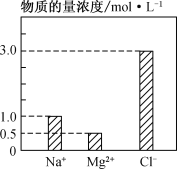
�ٸû��Һ�У�NaCl�����ʵ���Ϊ________mol��������MgCl2������Ϊ________g��
�ڸû��Һ��CaCl2�����ʵ���Ϊ________mol�����û��Һ��ˮϡ�������Ϊ1 L��ϡ�ͺ���Һ��Ca2�������ʵ���Ũ��Ϊ________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����(����)
A.1 mol�״������к��еĹ��ۼ���Ϊ4NA
B.2.4 gþ��������������ȼ��,ת�Ƶĵ�����Ϊ0.1NA
C.��״����,5.6 L������̼�����к��е���ԭ����Ϊ0.5NA
D.1 L 0.5 mol/L CH3COONa��Һ�к��е�CH3COO-��Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaNO2����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж�����֪NaNO2�ܷ������·�Ӧ��2NaNO2+4HI�T2NO��+I2+2NaI+2H2O��
��1��������Ӧ����������___������������___����д��ѧʽ����
��2������������Ӧ������NaNO2��NaCl����ѡ�õ������У���ˮ�����⻯�ص�����ֽ�������ۡ����ơ���ʳ�ף�����Ϊ����ѡ�õ�������______������ţ���
��3��ij����Һ�У�����2%��5%��NaNO2��ֱ���ŷŻ������Ⱦ�������Լ���ʹNaNO2ת��Ϊ�����������Ⱦ��N2����______�����ţ���
A��NaClB��NH4ClC��HNO3D��ŨH2SO4
��4����ѧ����ʽ��10Al+6NaNO3+4NaOH�T10NaAlO2+3N2��+2H2O������Ӧ������ת��5mole-�������ɱ�״����N2�����Ϊ______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������У��˴Ź�������ֻ����������ҷ����֮��Ϊ3��2��2����(����)
A. ![]()
B. 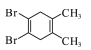
C. ![]()
D. 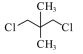
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̿�ɴ���������Ⱦ��NO��Ϊģ��ù��̣�T��ʱ����3L�ܱ������м���NO�ͻ���̿�ۣ���Ӧ��ϵ�и����ʵ����仯���±���ʾ������˵����ȷ����
����̿/mol | NO/mol | X/mol | Y/mol | |
��ʼʱ | 2.030 | 0.100 | 0 | 0 |
10min��ƽ�� | 2.000 | 0.040 | 0.030 | 0.030 |
A. Xһ����N2��Yһ����CO2
B. 10min������ѹǿ��NO������������
C. 10min��������̿��ƽ��������Ӧ�����ƶ�
D. 0~10min��ƽ����Ӧ����v(NO)=0.002 mol/(Lmin)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����20mL0.1 mol/L H2R��Һ�еμ�0.1 mol/LNaOH��Һ����Һ��pH��NaOH��Һ����ı仯��ͼ��ʾ����֪pKa=��lgKa����Ԫ����H2R��pKa1=1.89��pKa2=7.21�������й�˵���������

A. ��Һ�ĵ����ԣ���a���ڵ�b
B. ����Ũ��c(R2-)����cС�ڵ�d
C. H2R + R2-=2HR-ƽ�ⳣ��>105����Ӧ������ȫ
D. ��bʱ��y<7��![]() <1
<1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Na2CO3 ��NaHCO3�������ж���ȷ����![]() �� ��
�� ��![]()
A.�������ܽ�ȣ�Na2CO3<NaHCO3
B.���ȶ��ԣ�Na2CO3<NaHCO3
C.��ͬŨ�����ᷴӦ�ľ��ҳ̶ȣ�Na2CO3>NaHCO3
D.�����ʯ��ˮ��Ӧ�����а�ɫ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com