
【题目】(1) 按要求写出下列反应的方程式。
①醋酸电离方程式:______________。
②一水合氨电离方程式:_______________________。
③碳酸氢钠与氢氧化钠反应离子方程式:___________。
(2) 在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如下图所示,回答下列问题:
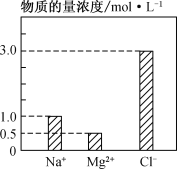
①该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
②该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L-1。
【答案】CH3COOH![]() CH3COO-+H+ NH3H2O
CH3COO-+H+ NH3H2O![]() NH4++OH- OH-+HCO3-=CO32-+H2O 0.2 9.5 0.1 0.1
NH4++OH- OH-+HCO3-=CO32-+H2O 0.2 9.5 0.1 0.1
【解析】
(1)①醋酸是弱酸,在溶液中部分电离出氢离子和醋酸根离子,电离方程式为CH3COOH![]() CH3COO-+H+,故答案为:CH3COOH
CH3COO-+H+,故答案为:CH3COOH![]() CH3COO-+H+;
CH3COO-+H+;
②一水合氨是弱碱,在溶液中部分电离出氢氧根离子和铵根离子,电离方程式为NH3H2O![]() NH4++OH-,故答案为:NH3H2O
NH4++OH-,故答案为:NH3H2O![]() NH4++OH-;
NH4++OH-;
③在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠和水,反应离子方程式为OH-+HCO3-=CO32-+H2O,故答案为:OH-+HCO3-=CO32-+H2O;
(2)①由图可知,该混合液中钠离子和镁离子的物质的量浓度分别为1.0mol/L和0.5mol/L,则氯化钠的物质的量为1.0mol/L×0.2 L=0.2mol,氯化镁的物质的量为0.5mol/L×0.2 L=0.1mol,则氯化镁的质量为0.1mol×95g/mol=9.5g,故答案为:0.2;9.5;
②溶液中存在电荷守恒关系:c(Na+)+2c(Mg2+)+2c(Ca2+)=c(Cl﹣),由题给数据可知1.0 molL﹣1+0.5 molL﹣1×2+c(Ca2+)×2=3 molL﹣1×1,解得c(Ca2+)=0.5 molL﹣1,c(CaCl2)=0.5 molL﹣1,则氯化钙的物质的量为0.5mol/L×0.2L=0.1mol,由稀释定律可知,稀释前后氯化钙的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为![]() =1mol/L,故答案为:0.1;0.1。
=1mol/L,故答案为:0.1;0.1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有某两种金属混合物4.5g,将其与足量的稀硫酸反应,能产生2.24L氢气(标准状况),则这两种金属可能是
A.镁和铝B.铝和钠C.钠和铜D.铜和锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下废液中NH4+能转化为N2(g)和H2O(l),示意图如下:
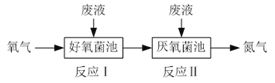
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH1=a kJ·mol-1
反应II:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是
A. 两池发生的反应中氮元素只被氧化
B. 两池中投放的废液体积相等时NH4+能完全转化为N2
C. 常温常压下,反应II中生成22.4 L N2转移的电子数为3.75×6.02×1023
D. 4NH4+(aq)+3O2(g)=2N2(g)+4H+(aq)+6H2O(l) ΔH=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠在一定条件下可以相互转化。
(1)向碳酸钠溶液中通入二氧化碳,可以得到碳酸氢钠,请写出该反应的化学方程式_________。
(2)请设计实验方案除去碳酸钠固体中混有的少量碳酸氫钠_________。
(3)请设计实验方案除去碳酸氢钠溶液中混有的少量碳酸钠_________。
(4)充分加热碳酸钠和碳酸氢钠的混合物95g,完全反应后得到气体5.6L(标准状况),求混合物中碳酸钠的质量分数_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的图示与对应的叙述相符的是( )
A.如图表示向A1Cl3溶液中滴加NaOH溶液时n [Al(OH)3]的变化情况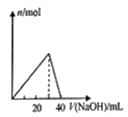
B.如图表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
C.如图表示某一放热反应,若使用催化剂,E1、E2、△H都会发生改变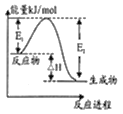
D.如图表示向Na2CO3溶液中滴加稀盐酸时,产生n (CO2)的情况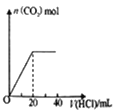
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
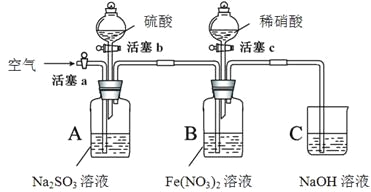
实验记录如下:
实验操作 | 实验现象 | |
I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
V | 打开活塞a,通入一段时间空气 | ———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2++ NO![]() [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
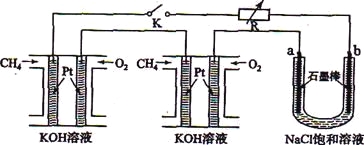
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为
(法拉第常数F=9.65×l04C.mol-1,列式计算),最多能产生的氯气体积为 L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com