
【题目】今有某两种金属混合物4.5g,将其与足量的稀硫酸反应,能产生2.24L氢气(标准状况),则这两种金属可能是
A.镁和铝B.铝和钠C.钠和铜D.铜和锌
【答案】B
【解析】
假设金属都为+2价,根据电子转移守恒计算金属物质的量,再根据M=m÷n计算平均相对原子质量,平均相对原子质量应介于各组分之间,若金属不与稀硫酸反应,由电子转移守恒,可以视作其相对原子质量为无穷大,若反应中金属不表现+2价,按化合价与相对分子质量成正比关系折算+2价时相对分子质量。
标况下,2.24L氢气的物质的量为![]() =0.1mol,假设金属都为+2价,根据电子转移守恒,金属物质的量为0.1mol,金属平均相对原子质量为
=0.1mol,假设金属都为+2价,根据电子转移守恒,金属物质的量为0.1mol,金属平均相对原子质量为![]() =45。
=45。
A、Mg、Al均与硫酸反应生成氢气,Mg表现+2价,Mg相对原子质量为24,而Al表现+3价,若化合价为+2价,其相对分子质量折算为![]() =18,相对分子质量均小于45,故A不符合;
=18,相对分子质量均小于45,故A不符合;
B、铝和钠均与硫酸反应生成氢气,Na表现+1价,Na相对原子质量为23,其相对分子质量折算为23×2÷1=46,而Al表现+3价,若化合价为+2价,其相对分子质量折算为27×2÷3=18,相对分子质量一个小于45,另一个大于45,故B符合;
C、钠和铜,钠与硫酸反应生成氢气,Na表现+1价,Na相对原子质量为23,其相对分子质量折算为23×2÷1=46,铜不与硫酸反应,Cu的相对原子质量视作无穷大,相对分子质量均大于45,故C不符合;
D、铜和锌,铜不与硫酸反应,Cu的相对原子质量视作无穷大,锌与硫酸反应生成氢气,Zn表现+2价,Zn相对原子质量为65,相对分子质量均大于45,故D不符合;
故选B。


科目:高中化学 来源: 题型:
【题目】在某稀溶液中含有0.2 mol HNO3和x mol H2SO4,向其中加入25.6 g铜粉,充分反应后产生的气体在标准状况下的体积为4.48 L,则x值至少为( )
A.0.6B.0.4C.0.3D.0.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。三种晶体的熔点由高到低的顺序是______(填化学式)。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为________(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是________,由非极性键形成的非极性分子是________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是__________,属于离子晶体的是_________,属于原子晶体的是_______,五种物质的熔点由高到低的顺序是__________。
(4)A、B、C、D为四种晶体,性质如下:
A 固态时能导电,能溶于盐酸
B 能溶于CS2,不溶于水
C 固态时不导电,液态时能导电,可溶于水
D 固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.______;B.______;C.________;D._____。
(5)相同压强下,部分元素氟化物的熔点见下表:
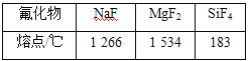
试解释上表中氟化物熔点差异的原因:__________
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是________晶体,Ni(CO)4易溶于下列________(填序号)
a 水 b 四氯化碳 c 苯 d 硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是( )
①![]()
②![]()
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A.①③⑤B.②③④C.②④⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是

A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
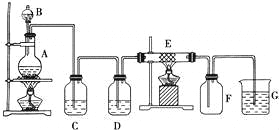
(1)C、G两个装置所盛放的试剂分别是: C G .
(2)①装置搭好须进行气密性检查,写出操作方法: .
②两处酒精灯应先点燃 处(填写A或B),目的是 .
③F中的现象为 ,G中出现了一种沉淀,该沉淀的化学式 .
(3)写出在A、E中发生反应的化学方程式为:
A: .
E: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 按要求写出下列反应的方程式。
①醋酸电离方程式:______________。
②一水合氨电离方程式:_______________________。
③碳酸氢钠与氢氧化钠反应离子方程式:___________。
(2) 在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如下图所示,回答下列问题:
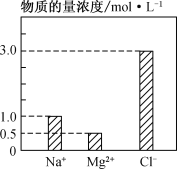
①该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
②该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭可处理大气污染物NO。为模拟该过程,T℃时,在3L密闭容器中加入NO和活性炭粉,反应体系中各物质的量变化如下表所示。下列说法正确的是
活性炭/mol | NO/mol | X/mol | Y/mol | |
起始时 | 2.030 | 0.100 | 0 | 0 |
10min达平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
A. X一定是N2,Y一定是CO2
B. 10min后增大压强,NO的吸收率增大
C. 10min后加入活性炭,平衡向正反应方向移动
D. 0~10min的平均反应速率v(NO)=0.002 mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com