
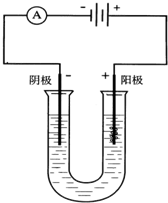
 如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.
如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.分析 (1)以石墨为电极电解AgNO3溶液,阳极上H2O失电子生成O2和H+,阴极上Ag+得电子生成Ag;
(2)以石墨为电极电解NaCl溶液时,阴极上H2O得电子生成H2和OH-,阳极上Cl-失电子生成Cl2.
解答 解:(1)①以石墨为电极电解AgNO3溶液,阳极上H2O失电子生成O2和H+,阳极反应式为4OH--4e-═O2↑+2H2O;
②阴极上Ag+得电子生成Ag,阴极反应式为Ag++e-=Ag,
③电池反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4OH--4e-═O2↑+2H2O;Ag++e-=Ag;4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3;
(2)①以石墨为电极电解NaCl溶液时,阳极上Cl-失电子生成Cl2,电极反应式为2Cl--2e-═Cl2↑;
②阴极上H2O得电子生成H2和OH-,阴极反应式物为2H2O+2e-═H2↑+2OH-,
③电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2Cl--2e-═Cl2↑;2H2O+2e-═H2↑+2OH-;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题以电极反应式书写为载体考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,熟练掌握阴阳离子放电顺序,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | C2H5Cl→CH2=CH2 | B. | CH3CHO→C2H5OH | ||
| C. |  | D. | CH3COOH→CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
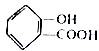
 与
与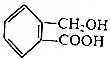 互为同系物
互为同系物 ,请写出将
,请写出将 转化为
转化为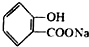 的化学方程式
的化学方程式 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol | B. | 0.6 mol | C. | 0.8 mol | D. | 1.0 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲一定是强碱 | B. | 乙一定是弱碱 | C. | 乙一定是二元碱 | D. | 甲一定是一元碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化是物理变化 | |
| B. | 煤的干馏是化学变化 | |
| C. | 石油裂解的目的是为了提高轻质油的产量和质量 | |
| D. | 石油的分馏是物理变化,得到的各个馏分都是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
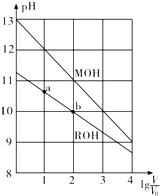
| A. | MOH的碱性强于ROH的碱性 | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 当1g$\frac{V}{{V}_{0}}$=2时,若两溶液同时升温,则$\frac{c({M}^{+})}{c({R}^{+})}$增大 | |
| D. | 若两溶液无限稀释,则它们的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | 非金属性:A>C | |
| D. | 单质B常温下能溶于浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com