
| A. | 原子半径:A<B<C<D | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | 非金属性:A>C | |
| D. | 单质B常温下能溶于浓硝酸 |
分析 短周期主族元素A、B、C、D,原子序数依次增大;B原子最外层电子数等于A原子最外层电子数的一半,则A不是H元素,这几种元素位于第二或第三周期,A、C的原子序数之差为8,则A、C位于同一主族,A、C原子最外层电子数相等,A、B、C三种元素原子的最外层电子数之和为15,且B原子最外层电子数等于A原子最外层电子数的一半,令B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C、D,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素;
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
C.同一主族元素,元素的非金属性随着原子序数增大而减弱;
D.B单质是Al,常温下和浓硝酸发生钝化现象.
解答 解:短周期主族元素A、B、C、D,原子序数依次增大;B原子最外层电子数等于A原子最外层电子数的一半,则A不是H元素,这几种元素位于第二或第三周期,A、C的原子序数之差为8,则A、C位于同一主族,A、C原子最外层电子数相等,A、B、C三种元素原子的最外层电子数之和为15,且B原子最外层电子数等于A原子最外层电子数的一半,令B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C、D,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素;
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,这几种元素原子半径大小顺序是B>C>D>A,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,非金属性D>C,则最高价氧化物对应水化物的酸性:D>C,故B错误;
C.同一主族元素,元素的非金属性随着原子序数增大而减弱,则非金属性A>C,故C正确;
D.B单质是Al,常温下和浓硝酸发生钝化现象而阻止Al和浓硝酸进一步反应,故D错误;
故选C.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断及知识综合运用能力,明确原子结构、元素周期表结构、元素周期律及物质性质是解本题关键,注意物质性质特殊性,易错选项是D.


科目:高中化学 来源: 题型:实验题
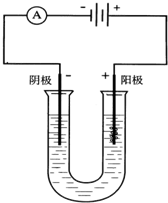 如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.
如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解后溶液中c(H+)为2 mol•L-1 | B. | 上述电解过程中转移电子总数为NA | ||
| C. | 电解得到的Cu的物质的量为1 mol | D. | 原混合溶液中 c(K+)为5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
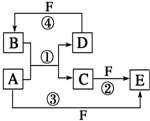 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 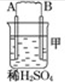 | 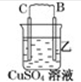 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com