
分析 短周期的五种主族元素A、B、C、D、E原子序数依次变小,E为周期表中原子半径最小的元素,则E为H元素;C为自然界含量最多的金属元素,则C为Al元素;D的最外层电子数为次外层的2倍,次外层电子数为2,最外层电子数为4,则D为C元素;B、D属于同一主族,则B为Si元素;A的单质在常温下为气态,A为第三周期的非金属元素,则A为Cl元素,然后利用元素及其单质、化合物的性质来解答.
解答 解:短周期的五种主族元素A、B、C、D、E原子序数依次变小.E为周期表中原子半径最小的元素,则E为H元素;C为自然界含量最多的金属元素,则C为Al;D的最外层电子数为次外层的2倍,次外层电子数为2,最外层电子数为4,则D为C;B、D属于同一主族,则B为Si;A的单质在常温下为气态,A为第三周期的非金属元素,则A为Cl,
(1)由上述推断可知,A为氯,B为硅,
故答案为:氯;硅;
(2)B为Si、D为C元素,同一主族中原子序数越大,原子半径越小,则原子半径较大的为Si,
故答案为:Si;
(3)A为Cl、C为Al,A、C的最高价氧化物对应的水化物分别为高氯酸、氢氧化铝,氢氧化铝与盐酸反应生成氯化铝和水,离子方程方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)A为Cl、D为C元素,非金属性越强,最高价含氧酸的酸性越强,则A、D的最高价氧化物对应的水化物的酸性弱的为碳酸,化学式为:H2CO3;
非金属性越强,气态氢化物越稳定,非金属性:Cl>C,则氢化物稳定性强的为HCl,
故答案为:H2CO3;HCl.
点评 本题考查原子结构与元素周期律关系,题目难度中等,元素的推断是解答的关键,熟悉元素及其化合物知识即可解答,注意掌握原子结构与元素周期表、元素周期律的关系.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | 非金属性:A>C | |
| D. | 单质B常温下能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
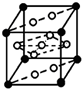 已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KW随浓度的改变而改变 | |
| B. | 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
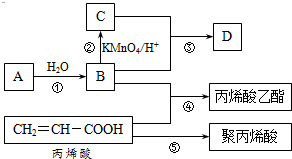 A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示v(反应条件已省略):
A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示v(反应条件已省略): ,C中官能团的名称为羧基.
,C中官能团的名称为羧基. ,加聚反应.
,加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
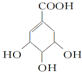 .(提示:环丁烷
.(提示:环丁烷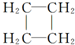 可简写成□)
可简写成□)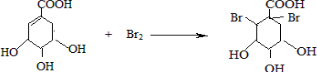 .
.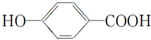 ),其反应类型是消去反应.
),其反应类型是消去反应. 中任意一种.
中任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
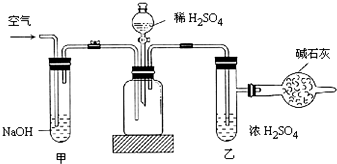
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com