
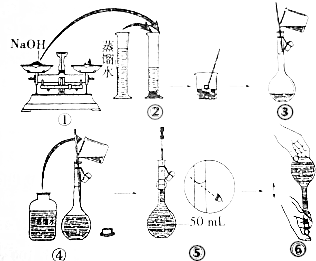
分析 配制一定物质的量浓度的NaOH溶液的步骤是:
(1)计算:所称取固体的质量;
(2)称量:氢氧化钠应放在烧杯中称量;
(3)溶解:在烧杯中进行,溶解过程中有热效应,还要冷却,这是因为容量瓶的容量、规格是受温度限制的,如果未冷却,会因为热胀效应而产生误差;
(4)移液:转移液体时要用玻璃棒引流,且其下端一般应靠在容量瓶内壁的刻度线以下部位;
(5)洗涤:用蒸馏水洗涤烧杯和玻璃棒2~3次,其目的是使溶质尽可能地转移到容量瓶中,以防产生误差;
(6)定容:当向容量瓶中加水至刻度线1 cm~2 cm处时,再改用胶头滴管至刻度处,视线应平视;
(7)摇匀:这时如果液面低于刻度线,不要再加水;
(8)装瓶:容量瓶不能长时间盛放液体,应盛装在指定的试剂瓶中,并贴好标签.
解答 解:氢氧化钠为腐蚀品,应放在小烧杯中称量,故①错误;
溶解氢氧化钠应在烧杯中进行,量筒不能作溶解的容器,故②错误;
移液时要用玻璃棒引流,且其下端一般应靠在容量瓶内壁的刻度线以下部位,故③错误;
用蒸馏水洗涤烧杯和玻璃棒2~3次,其目的是使溶质尽可能地转移到容量瓶中,以防产生误差,故④正确;
定容时用胶头滴管至刻度处,视线应平视,故⑤错误;
最后盖上瓶塞上下颠倒摇匀,故⑥正确;
所以不正确的操作有①②③⑤;
故答案为:①②③⑤.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制的正确操作步骤是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol | B. | 0.6 mol | C. | 0.8 mol | D. | 1.0 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl (NaCl ) | B. | MgSO4(MgO) | C. | CuSO4(CuO) | D. | CuCl2(CuCl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | 非金属性:A>C | |
| D. | 单质B常温下能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com