
【题目】某工厂采用如图装置处理化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为惰性电极。下列说法错误的是
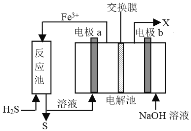
A.电极a电极反应式为Fe2+- e-=Fe3+
B.该装置能实现由H2S转化为S和H2
C.若交换膜为质子交换膜,则NaOH溶液的浓度逐渐变大,需要定期更换
D.若交换膜为阳离子交换膜,b电极区会产生红褐色沉淀
【答案】C
【解析】
电极a有Fe3+生成,则a为电解池阳极,b为电解池阴极;Fe3+在反应池中与硫化氢发生氧化还原反应,还原产物Fe2+可再进入电解池中放电;
A.电极a有Fe3+生成,则a为电解池阳极,发生氧化反应,电极反应为:Fe2+- e-=Fe3+,故A正确;
B.反应池中Fe3+与硫化氢发生氧化还原反应,生成Fe2+、硫、氢离子,发生的反应为H2S +2Fe3+ = 2Fe2+ +S↓+2H+,故B正确;
C.阴极上,水电离的氢离子放电生成氢气,若交换膜为质子交换膜,则氢离子会向氢氧化钠溶液移动,消耗的氢离子与迁移的氢离子的数量相同, NaOH溶液的浓度不变,故C错误;
D.若交换膜为阳离子交换膜,Fe3+会向阴极移动,与氢氧根离子生成红褐色沉淀Fe(OH)3,故D正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】异丙烯苯和异丙苯是重要的化工原料,二者存在如图转化关系:

下列说法正确的是
A. 异丙烯苯分子中所有碳原子一定共平面
B. 异丙烯苯和乙苯是同系物
C. 异丙苯与足量氢气完全加成所得产物的一氯代物有6种
D. 0.05mol异丙苯完全燃烧消耗氧气13.44L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
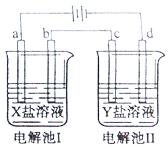
选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氰酸盐在化学工业中应用广泛。
(1)组成硫氰酸根(SCN -)的三种元素的部分性质见下表:
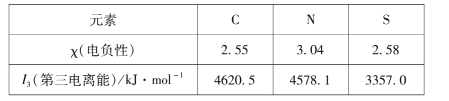
①硫氰酸根中碳元素的化合价为____。
②碳元素的I1、I2均比氮小。但I3却比氮高,其原因是____。
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是____(填标号)。
A KSCN B Fe(SCN)3 C Ni(SCN)2 D Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、(CN)2及N2。
①SCN-可能具有[S-C≡N]-和____(填结构式)两种结构,中心原子碳的轨道杂化方式均为____。
②(CN)2熔沸点高于N2的原因是____。
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。
①晶体中微粒间作用力有____(填标号)。
A 金属键 B 氢键 C 非极性键 D 极性键 E 配位键
②晶体的化学式为____。
③硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm.c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=____g·cm-3(列计算式)。
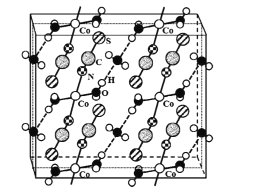
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成,下列说法错误的是
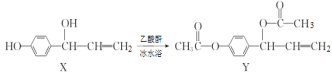
A.X转化成Y为取代反应
B.X、Y分子中含有的手性碳原子数不相同
C.1molX与溴水充分反应,最多消耗Br2的物质的量为3mol
D.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法错误的是
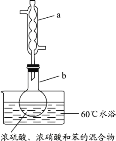
A.仪器a的作用是冷凝回流,下口为进水口
B.水浴加热的优点为使反应物受热均匀、容易控制温度
C.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将混合酸逐滴滴入苯中
D.反应完全后,用仪器a蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据),根据下图回答下列问题:
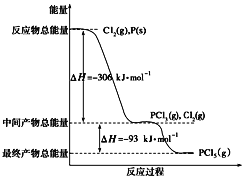
(1)PCl5分解生成PCl3和Cl2的热化学方程式__________________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8 mol PCl5,反应达到平衡时生成标准状况下4.48LCl2,其分解率a1为_________;若反应温度由T1升高到T2,平衡时PCl5的分解率a2,a2______a1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是__________________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应ⅠFe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;
FeO(s)+CO(g) ΔH1,平衡常数为K1;
反应ⅡFe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;
FeO(s)+H2(g) ΔH2,平衡常数为K2;
在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①由表中判断,反应Ⅰ为中ΔH1______ (填“<”或“=”或“>”) 0。
②反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
③能判断CO2(g)+H2(g) ![]() CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
E.容器内的气体密度不变 F.混合气体的平均摩尔质量不变。
(2)在不同温度和压强下合成氨,起始时投入氮气和氢气的物质的量分别为1mol、3mol。平衡时混合物中氨的体积分数与温度的关系如图。
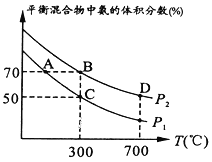
①P1_______P2 (填“>”“=” “<”或“不确定”,)。
②C点H2的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com