
����Ŀ�����û�ѧ��Ӧԭ���о�̼�����ĵ��ʼ��仯����ķ�Ӧ�Ի������Ⱦ����ԴΣ��������Ҫ���塣
(1)��Ӧ��Fe(s)��CO2(g) ![]() FeO(s)��CO(g)����H1��ƽ�ⳣ��ΪK1��
FeO(s)��CO(g)����H1��ƽ�ⳣ��ΪK1��
��Ӧ��Fe(s)��H2O(g) ![]() FeO(s)��H2(g)����H2��ƽ�ⳣ��ΪK2��
FeO(s)��H2(g)����H2��ƽ�ⳣ��ΪK2��
�ڲ�ͬ�¶�K1��K2ֵ���±���
700 �� | 900 �� | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
���ɱ����жϣ���Ӧ��Ϊ����H1______ (����<������=������>��) 0��
�ڷ�ӦCO2(g)��H2(g) ![]() CO(g)��H2O(g)����Hƽ�ⳣ��ΪK����K��________(��K1��K2��ʾ)��
CO(g)��H2O(g)����Hƽ�ⳣ��ΪK����K��________(��K1��K2��ʾ)��
�����ж�CO2(g)��H2(g) ![]() CO(g)��H2O(g)�ﵽ��ѧƽ��״̬��������________(����ĸ)��
CO(g)��H2O(g)�ﵽ��ѧƽ��״̬��������________(����ĸ)��
A.������ѹǿ���� B.���������c(CO)����
C.v��(H2)��v��(H2O) D.c(CO)��c(CO2)
E.�����ڵ������ܶȲ��� F.��������ƽ��Ħ���������䡣
(2)�ڲ�ͬ�¶Ⱥ�ѹǿ�ºϳɰ�����ʼʱͶ�뵪�������������ʵ����ֱ�Ϊ1mol��3mol��ƽ��ʱ������а�������������¶ȵĹ�ϵ��ͼ��
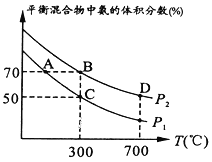
��P1_______P2 (����>����=�� ��<��������ȷ������)��
��C��H2��ת����Ϊ________��
���𰸡�> ![]() BC < 66.7��
BC < 66.7��
��������
(1)�����û�ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬��Ũ���أ�Ȼ�������¶ȶԻ�ѧƽ���ƶ�Ӱ����з�����
�����û�ѧƽ�ⳣ������ʽ���з�����
�����û�ѧƽ��״̬�Ķ�����з�����
(2)�����õ����£�ѹǿ�Ի�ѧƽ���ƶ���Ӱ����з�����
�����á�����ʽ�������м��㣻
(1)�ٸ��ݱ��������ݣ��¶����ߣ�K1����˵�������¶ȣ�ƽ��������Ӧ�����ƶ�������H1>0��
�ڸ��ݻ�ѧƽ�ⳣ���Ķ��壬K1=![]() ��K2=
��K2=![]() ��K=
��K=![]() ,�Ƴ�K=
,�Ƴ�K=![]() ��
��
��A. �÷�Ӧ���ص㣺��Ӧǰ������ϵ��֮����ȣ�����Ӧǰ���������ʵ������䣬�Ӷ��Ƴ�ѹǿ���䣬����˵����Ӧ�ﵽƽ�⣬��A���������⣻
B. ���ݻ�ѧƽ��״̬�Ķ��壬��c(CO)���ٸı䣬˵����Ӧ�ﵽƽ�⣬��B�������⣻
C. v��(H2)��ʾ������Ӧ������У�v��(H2O)��ʾ���淴Ӧ������У���H2��H2O��ϵ����ͬ��v��(H2)��v��(H2O)�ܹ�˵����Ӧ�ﵽƽ�⣬��C�������⣻
D. ͨ������Ũ����ȣ�����˵����Ӧ�ﵽƽ�⣬��D���������⣻
E. ��Ӧǰ������ϵ��֮����ȣ����������������ֲ��䣬��ֶ������壬�������������ֲ��䣬����ܶȲ��䣬����˵����Ӧ�ﵽƽ�⣬��E���������⣻
F. ��Ӧǰ������ϵ��֮����ȣ����������ʵ������ֲ��䣬�������������ֲ��䣬���ƽ��Ħ���������䣬����˵����Ӧ�ﵽƽ�⣬��F���������⣻
(2)�ٺϳɰ��ķ�Ӧ����ʽΪN2��3H2 ![]() 2NH3����ͬ�����£�ѹǿԽ��ƽ��������Ӧ������У�NH3�����������P2>P1��
2NH3����ͬ�����£�ѹǿԽ��ƽ��������Ӧ������У�NH3�����������P2>P1��
�� ��C�㰱���������Ϊ
��C�㰱���������Ϊ![]() ��100%=50%�����x=
��100%=50%�����x=![]() ����H2��ת����Ϊ
����H2��ת����Ϊ![]() ��100%��66.7%��
��100%��66.7%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��˳��1��2������������ͷ���1��2������������ɷ�������ת����

�÷�Ӧ�����ʷ��̿ɱ�ʾΪ��v������=k��������c��˳����v���棩=k���棩��c��������k��������k���棩�ֱ���������淴Ӧ���ʳ������������¶Ⱥʹ���Ӱ�졣�����й�˵����ȷ���ǣ� ��
A.ij�¶�ʱ���÷�Ӧ��ƽ�ⳣ���ɱ�ʾΪK=![]()
B.�����淴Ӧ���ʳ����ı䣬ƽ�ⳣ��Ҳһ������֮�ı�
C.�������¶ȣ�ƽ�������ƶ�����˵������Ӧ�Ļ�ܸ����淴Ӧ�Ļ��
D.�������Ըı䷴Ӧ���ʵ���Ӱ��ƽ�⣬˵������ͬ�ȳ̶ȸı�k��������k���棩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������ͼװ�ô�����ʯȼ�Ͽ��ɡ��ӹ����̲�����H2S��������֪�����е������缫��Ϊ���Ե缫������˵���������
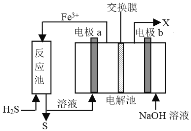
A.�缫a�缫��ӦʽΪFe2+- e-=Fe3+
B.��װ����ʵ����H2Sת��ΪS��H2
C.������ĤΪ���ӽ���Ĥ����NaOH��Һ��Ũ�������Ҫ���ڸ���
D.������ĤΪ�����ӽ���Ĥ��b�缫����������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ŷ����Ƴ���TM��LiH��TM��ʾ���ɽ�������˫������ϵ��������������º������µ����������ϳ�NH3��Ч�ʣ�ԭ��ʾ�����£�

���з������������ǣ�������
A.״̬��������������N��N����������B.�ϳ�NH3�ܷ�Ӧ��ԭ����������100%
C.��TM��LiH���ܽ��ͺϳɰ���Ӧ�ġ�HD.����NH3��2LiNH+3H2�T2LiH+2NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʵ�Ľ�����ȷ���ǣ� ��
ѡ�� | �������ʵ | ���� |
A | ���ȵĴ�����Һȥ������ | ����������ֱ�ӷ�����Ӧ������������ˮ������ |
B | ʩ��ʱ����ľ��(��Ч�ɷ�ΪK2CO3)������NH4Cl���ʹ�� | K2CO3��NH4Cl��Ӧ���ɰ����ή�ͷ�Ч |
C | Ư���ڿ����о��ñ��� | Ư���е�ClO-����ˮ���HClO |
D | FeCl3��Һ������ˮ���� | FeCl3��Fe3+���������Կ�ɱ������ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͷ�к����������ף�P4S3��������һ�ֻ�ɫ���塣P4S3�Ľṹ�о��������÷�����û�в����ͼ����Ҹ�ԭ�ӵ��������ﵽ��8���ӽṹ���÷����к��й��ۼ������ǣ� ��
A.10��B.9��C.8��D.7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����Na2SO3��Һ�������Ṥҵβ���е�SO2����ͨ����ⷽ��ʵ������Һ��ѭ���������������������ӽ���Ĥ���ѭ������������ͼ��ʾ�������й�˵������ȷ����
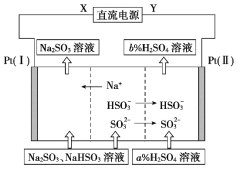
A.XӦΪֱ����Դ������
B.��������������pH����
C.ͼ�е�b%��a%
D.SO32���ڵ缫�Ϸ����ķ�ӦΪSO32����2OH����2e��=SO42����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A.���³�ѹ�£�19gH3O+����10NA������
B.4.0gH218O��D2O�Ļ����������������Ϊ2NA
C.��״���£�22.4LCH4��C2H4�Ļ������������ԭ����Ϊ4NA
D.��3.0gHCHO��ˮ��Һ��ԭ������Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���pH��Ϊ3�������ΪV0��HA��HB��Һ���ֱ��ˮϡ�������V��pH��1g![]() �ı仯����ͼ��ʾ������˵����ȷ����
�ı仯����ͼ��ʾ������˵����ȷ����
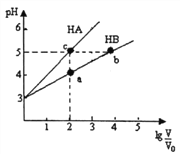
A. ϡ����ͬ����ʱ��c(A��)>c(B��-)
B. ˮ�ĵ���̶ȣ�b=c>a
C. ��Һ�����������ʵ�����b>c>a
D. ��Һ��������Ũ�ȣ�a>b>c
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com