
【题目】火柴头中含有三硫化四磷(P4S3),它是一种黄色晶体。P4S3的结构研究表明,该分子中没有不饱和键,且各原子的最外层均达到了8电子结构。该分子中含有共价键条数是( )
A.10个B.9个C.8个D.7个
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】侯氏制碱法(联合制碱法)工艺流程可用图表示。
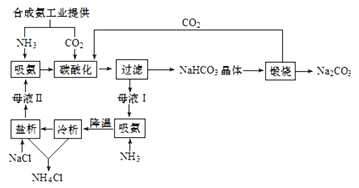
下列有关说法正确的是( )
A.合成氨工业提供的CO2来自焦炭燃烧
B.母液Ⅰ“吸氨”可抑制NH4+水解
C.CO2、NH3和H2O都得到循环利用
D.“冷析”和“盐析”降低了NH4Cl溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法错误的是
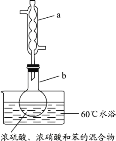
A.仪器a的作用是冷凝回流,下口为进水口
B.水浴加热的优点为使反应物受热均匀、容易控制温度
C.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将混合酸逐滴滴入苯中
D.反应完全后,用仪器a蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在相互转化、工业生产等方面应用广泛,回答下列问题。
(1)N2O是一种能刺激神经使人发笑的气体,可发生分解反应2N2O=2N2+O2,碘蒸气能大幅度提高N2O的分解速率,反应历程为:
第一步: I2(g)=2I(g) (快反应)
第二步: I(g)+N2O(g)=N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)=N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是_____(填标号)。
A.温度升高,该反应速率常数k值增大
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2作催化剂,其浓度大小与N2O分解速率无关
(2)温度为T1时,在二个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
容器编号 | 起始浓度/ mol·L-1 | 平衡浓度/ mol·L-1 | ||
c(NO) | c(O2) | c(NO2) | c(O2) | |
Ⅰ | 0.6 | 0.3 | 0 | 0.2 |
Ⅱ | 0.3 | 0.25 | 0.2 | |
①温度为T1时,![]() =________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
=________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
②容器Ⅱ中起始时v正_____v逆(填“>”“<”或“=”),理由是_______。
(3)NH3与CO2反应可合成尿素[化学式为CO(NH2)2],反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比
CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比![]() 和水碳比
和水碳比![]() 投料时,二氧化碳平衡转化率的情况。
投料时,二氧化碳平衡转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ中水碳比的数值分别为0.6~0.7,1~1.1,1.5~1.6,则生产中应选用的水碳比数值范围是______。
②在选择氨碳比时,工程师认为控制在4.0左右比较适宜,不选择4.5,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应ⅠFe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;
FeO(s)+CO(g) ΔH1,平衡常数为K1;
反应ⅡFe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;
FeO(s)+H2(g) ΔH2,平衡常数为K2;
在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①由表中判断,反应Ⅰ为中ΔH1______ (填“<”或“=”或“>”) 0。
②反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
③能判断CO2(g)+H2(g) ![]() CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
E.容器内的气体密度不变 F.混合气体的平均摩尔质量不变。
(2)在不同温度和压强下合成氨,起始时投入氮气和氢气的物质的量分别为1mol、3mol。平衡时混合物中氨的体积分数与温度的关系如图。
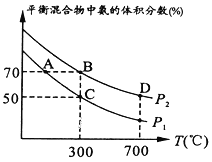
①P1_______P2 (填“>”“=” “<”或“不确定”,)。
②C点H2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.高氯酸的酸性与氧化性均大于次氯酸的酸性与氧化性
D.邻羟基苯甲醛的熔点高于对羟基苯甲醛的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示,H+、O2、NO3-等共存物会影响修复效果。下列说法错误的是
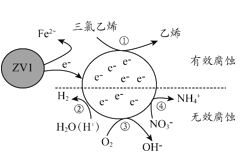
A.反应①②③④均为还原反应
B.1mol三氯乙烯完全脱Cl时,电子转移为3mol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.修复过程中可能产生Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
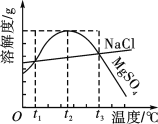
A. 只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B. t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C. 在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D. 把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行下列不同的操作,
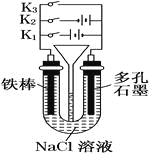
其中不正确的是
A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2
B.只接通K1,一段时间后,U形管中出现白色沉淀
C.只接通K2,U形管左、右两端液面均下降
D.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com