
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法错误的是
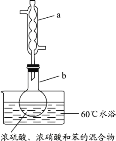
A.仪器a的作用是冷凝回流,下口为进水口
B.水浴加热的优点为使反应物受热均匀、容易控制温度
C.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将混合酸逐滴滴入苯中
D.反应完全后,用仪器a蒸馏得到产品
科目:高中化学 来源: 题型:
【题目】某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
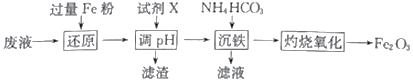
已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,在电子行业有可能取代石墨烯,其化合物钼酸钠晶体(Na2MoO42H2O)可制造阻燃剂和无公害型冷水系统的金属抑制剂。由钼精矿(主要成分MoS2,含有少量不反应杂质)制备钼及钼酸钠晶体的工艺流程如下:

(1)焙烧时,下列措施有利于使钼精矿充分反应的是________(填序号)。
a 增大钼精矿的量 b 将矿石粉碎 c 采用逆流原理混合
(2)操作1的名称是______,“碱浸”过程中反应的离子方程式为________。
(3)经“蒸发结晶”过程可得到钼酸钠晶体的粗品,要得到纯净的钼酸钠晶体,需要进行的操作2名称是_________。
(4)Mo元素有+4、+6两种价态,钼精矿中存在非整比晶体MoS2.7,则MoS2.7中Mo4+所占Mo元素的物质的量分数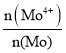 为__________。
为__________。
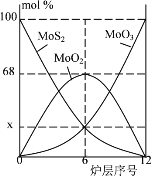
(5)焙烧钼精矿所用的装置是多层焙烧炉,如图为各炉层固体物料的物质的量的百分组成。图像中纵坐标x =_____。
(6)在实际生产中会有少量SO42-生成,用固体Ba(OH)2除去。在除SO42-前测定碱浸液中c(MoO42-)=0.80mol·L-1, c(SO42-)=0.04mol·L-1,当BaMoO4开始沉淀时,SO42-的去除率为94.5%,则Ksp(BaMoO4)=_________。[ Ksp(BaSO4)= 1.1×10-10,溶液体积变化、温度变化可忽略。]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂采用如图装置处理化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为惰性电极。下列说法错误的是
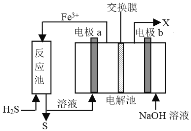
A.电极a电极反应式为Fe2+- e-=Fe3+
B.该装置能实现由H2S转化为S和H2
C.若交换膜为质子交换膜,则NaOH溶液的浓度逐渐变大,需要定期更换
D.若交换膜为阳离子交换膜,b电极区会产生红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:CO+2H2![]() CH3OH(g)。该可逆反应达到平衡的标志是________。
CH3OH(g)。该可逆反应达到平衡的标志是________。
A.2 v正(H2)= v逆(CH3OH)
B.单位时间生成m molCO的同时生成2m molH2
C.容器内气体的平均相对分子质量不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取化工原料气氢气,某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2L的恒容密闭容器中,测得如下表所示数据。
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
请回答下列问题:
①该温度下,上述反应的平衡常数K=________;
②反应在7~10min内,CO的物质的量减少的原因可能是____________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2L的恒容器密闭容器中同时充入0.2molCH4、0.62molH2O、a molCO和0.5molH2,当a =0.2时,上述反应向_____(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:

下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△HD.生成NH3:2LiNH+3H2═2LiH+2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火柴头中含有三硫化四磷(P4S3),它是一种黄色晶体。P4S3的结构研究表明,该分子中没有不饱和键,且各原子的最外层均达到了8电子结构。该分子中含有共价键条数是( )
A.10个B.9个C.8个D.7个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaAs晶体的熔点很高, 硬度很大, 密度为ρ g·cm-3,Ga 和As 的摩尔质量分别为MGag·mol-1和MAs g·mol-1, 原子半径分别为rGa pm 和rAs pm, 阿伏加德罗常数值为NA, 其晶胞结构如下图所示, 下列说法错误的是
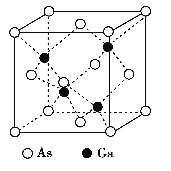
A. 该晶体为原子晶体
B. 在该晶体中,Ga和As均无孤对电子,Ga和As的配位数均为4
C. 原子的体积占晶胞体积的百分率为![]()
D. 所有原子均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com