
【题目】按如图所示装置进行下列不同的操作,
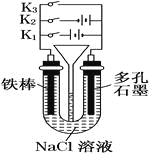
其中不正确的是
A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2
B.只接通K1,一段时间后,U形管中出现白色沉淀
C.只接通K2,U形管左、右两端液面均下降
D.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降
【答案】D
【解析】
A.只接通K1时,该装置是电解池,铁作阳极,腐蚀速度最快,只闭合K3时,该装置构成原电池,铁作负极发生吸氧腐蚀,腐蚀速度较快,只闭合K2时,该装置构成电解池,铁作阴极而被保护,所以铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2,A正确;
B.只接通K1,该装置是电解池,阳极上铁失电子生成亚铁离子,阴极上氢离子放电,同时阴极附近生成氢氧根离子,亚铁离子和氢氧根离子反应生成灰白色氢氧化亚铁沉淀,所以一段时间后,U形管中出现白色沉淀,B正确;
C.只接通K2,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以左右两端都有气体生成,压强增大导致U型管液面均下降,C正确;
D.先只接通K1,阴极上氢离子放电生成氢气导致U型管右端液面下降,则漏斗内液面上升,只接通K2,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以左右两端都有气体生成,压强增大导致U型管液面均下降,漏斗内液面上升,D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】火柴头中含有三硫化四磷(P4S3),它是一种黄色晶体。P4S3的结构研究表明,该分子中没有不饱和键,且各原子的最外层均达到了8电子结构。该分子中含有共价键条数是( )
A.10个B.9个C.8个D.7个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaAs晶体的熔点很高, 硬度很大, 密度为ρ g·cm-3,Ga 和As 的摩尔质量分别为MGag·mol-1和MAs g·mol-1, 原子半径分别为rGa pm 和rAs pm, 阿伏加德罗常数值为NA, 其晶胞结构如下图所示, 下列说法错误的是
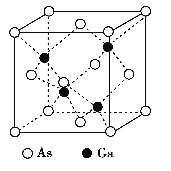
A. 该晶体为原子晶体
B. 在该晶体中,Ga和As均无孤对电子,Ga和As的配位数均为4
C. 原子的体积占晶胞体积的百分率为![]()
D. 所有原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y 、Z的原子序数依次增大,W、X同主族,Y原子的最外层电子数等于X原子的电子总数,Z原子的电子总数等于W、X、Y三种原子的电子数之和,Z的最高价氧化物对应水化物的化学式为HnZO2n+2。W、X、Y三种元素形成的一种化合物的结构如下图所示。下列说法错误的是

A.W的最高正价和最低负价的代数和为0
B.W的简单离子半径可能大于X的简单离子半径
C.Y的最高价氧化物对应的水化物属于弱碱
D.Z的单质的水溶液需保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g![]() 的变化如右图所示。下列说法正确的是
的变化如右图所示。下列说法正确的是
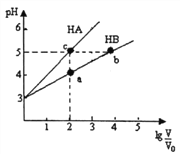
A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:

已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:

为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图设计的串联电池装置,R为变阻器,以调节电路电流。
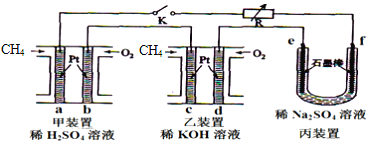
(1)写出b、c电极的电极反应式:b___,c___;
(2)写出f电极的电极反应式___,向此电极区域滴入酚酞的现象为:___;该电极区域水的电离平衡被___(填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH___(填“变大”、“变小”或“不变”),原因是___。
(4)电解一段时间后丙装置析出芒硝(Na2SO410H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入___gH2O就可以将析出的沉淀溶解并恢复到原有浓度。
(5)有一硝酸盐晶体,其化学式为M(NO3)xyH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.0100mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.320g。则
①金属M的相对原子质量为___;
②电解后,生成气体体积=___(标准状况下)溶液的pH=___(电解过程中溶液体积变化忽略不计)。要求写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
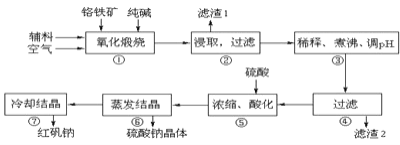
①中涉及的主要反应有:
主反应:![]()
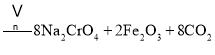
副反应: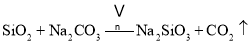 、
、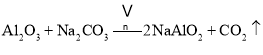
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:
![]() “①”
“①”
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】知识的梳理和感悟是有效学习的方法之一。山大附中高二化学兴趣小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(所有电极均为石墨)。电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42﹣及泥沙,其精制流程如下:
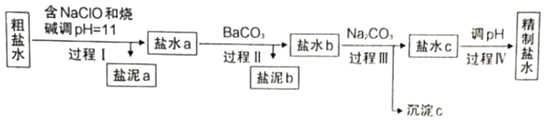
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如表。
Ca(OH)2 | Mg(OH)2 | |
pH | ≥11.5 | ≥9.2 |
②Ksp(BaSO4)=1.1×10﹣10,Ksp(BaCO3)=2.6×10﹣9,Ksp(CaCO3)=5.0×10﹣9
(1)盐泥a除泥沙外,还含有___________(填化学式)。
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为________________。
(3)过程Ⅲ中,沉淀c主要成分的化学式为_____。
(4)过程Ⅳ调pH目的是除去___________(填离子符号)
(5)利用图1装置电解精制氯化钠一段时间后,气球b中的气体是_____(填化学式)
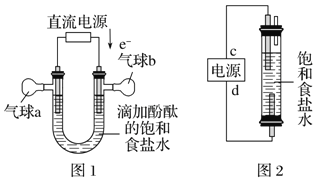
(6)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分NaClO,则c为电源的_____极;该发生器中反应的总离子方程式为_______________。
(7)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取ClO2的新工艺。
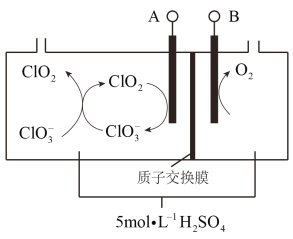
①阴极发生的反应有:_______________、__________________________。
②当阳极产生标准状况下112 mL气体时,通过阳离子交换膜离子的物质的量为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com