
【题目】氢、氮、氧、硫、镁、铁、铜、锌等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)某同学根据已学知识,推断 Mg 基态原子的核外电子排布为,![]() 该同学所画的电子排布图违背了____
该同学所画的电子排布图违背了____
(2)Cu 位于____族____区,Cu+价电子排布式为____。
(3)MgCO3的分解温度____ BaCO3(填“>” 或、“<”)
(4)Ge、As、Se 元素的第一电离能由大到小的顺序为____
(5)已知 H3BO3 是一元酸,1molH3BO3 在水中完全电离得到的阴离子中含有σ键的数目为____
(6)下列有关说法不正确的是____。
A.热稳定性:NH3 >PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2 与 CO2 的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4 ,原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小
(7)晶体 Cu 的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为_________,设Cu原子半径为a,晶体的空间利用率为______。(用含π,a、的式子表示,不必化简)

【答案】泡利原理 IB ds 3d10 < As>Se>Ge 8 NA(或 8×6.02×1023) AC 12 
【解析】
(1)Mg的3s轨道上的两个电子自旋方向相同;
(2)基态Cu的价电子排布式为3d104s1;
(3) 分解生成的MgO、BaO均为离子晶体,离子所带电荷相同,离子半径越小,晶格能越大,越稳定,反应越容易进行;
(4) 第一电离能在主族元素中同周期从左到右呈上升趋势;
(5) H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子;
(7)晶体 Cu 的堆积方式为面心立方最密堆积。
(1) 电子排布图中3s能级,2个电子自旋方向相同,违背泡利原理;
(2) 基态Cu的价电子排布式为3d104s1,Cu 位于第四周期的IB族ds区,Cu+价电子排布式为3d10;
(3) MgO、BaO均为离子晶体,离子所带电荷相同,Mg2+、Ba2+的半径依次增大,MgO的晶格能大于BaO的晶格能,导致MgCO3的分解温度小于BaCO3的分解温度;
(4) Ge、As、Se为同周期主族元素,核电荷数依次递增,第一电离能呈增大趋势,但As的4p转道为半充满结构相对稳定,第一电离能比Se大,则Ge、As、Se 元素的第一电离能由大到小的顺序为:As>Se>Ge;
(5) H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子,[A(OH)4]-的结构式为 单键均为σ键,则1mol[A(OH)4]-中含有σ键的数目为8 NA(或 8×6.02×1023);
单键均为σ键,则1mol[A(OH)4]-中含有σ键的数目为8 NA(或 8×6.02×1023);
(6) A.N的非金属性比P强,则热稳定性:NH3 >PH3,稳定性的差异与NH3分子间存在氢键无关,故A错误;
B.SiO2与CO2都是酸性氧化物,所以化学性质相似;SiO2是正四面体结构,采用sp3杂化,CO2是直线结构,采用sp2杂化,故B正确;
C.SiF4、SiCl4、SiBr4、SiI4都是分子晶体,结构相似,影响它们熔、沸点高低的主要因素是分子间作用力,不是化学键强弱,故C错误;
D.CaO、KCl、KBr都是离子晶体,影响熔、沸点高低的主要因素离子键,离子键强弱用晶格能来衡量,离子键越强晶格能越大。CaO的阴阳离子半径小、所带电荷多,所以离子键最强,晶格能最大;KBr的阴阳离子半径大、所带电荷少,所以离子键最弱,晶格能最小,故D正确;
故答案为AC;
(7) 晶体 Cu 的堆积方式为面心立方最密堆积,与Cu原子接触的硬球有3层,每层有4个与之等径且最近,因此晶体中Cu的配位数为4×3=12;对于面心立方最密堆积的晶胞而言,一个晶胞中含有的粒子个数为8×![]() +6×
+6×![]() =4,Cu原子半径为a,则晶胞内硬球的体积总和为V球=4×
=4,Cu原子半径为a,则晶胞内硬球的体积总和为V球=4×![]() πa3,根据面心立方最密堆积的硬球接触模型,设晶胞参数为b,根据立体几何知识,存在关系:
πa3,根据面心立方最密堆积的硬球接触模型,设晶胞参数为b,根据立体几何知识,存在关系:![]() b=4a,则b=2
b=4a,则b=2![]() a,因此晶胞的体积为V晶胞=(2
a,因此晶胞的体积为V晶胞=(2![]() a)3,所以,晶胞的空间利用率=
a)3,所以,晶胞的空间利用率=![]() ×100%=
×100%= 。
。


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是
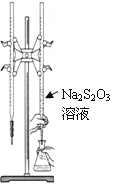
A. 该滴定可用甲基橙做指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定可选用右图所示装置
D. 该反应中每消耗2mol Na2S2O3,电子转移数为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
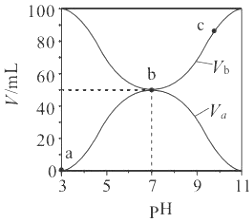
A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A. 保持体积不变,充入H2O(g)使体系压强增大
B. 将容器的体积缩小一半
C. 保持体积不变,充入N2使体系压强增大
D. 保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49 kJmol-1
CO2(g)+3H2(g) △H=+49 kJmol-1
副反应:H2(g)+CO2(g)![]() CO(g)+H2O(g) △H=+41 kJmol-1
CO(g)+H2O(g) △H=+41 kJmol-1
①甲醇在催化剂作用下裂解可得到H2和CO,则该反应的化学方程式为_________________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处_________________________。
③某温度下,将nH2O∶nCH3OH =1∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________________。(忽略副反应)
(2)工业常用CH4 与水蒸气在一定条件下来制取H2,其原理为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+203kJ·mol-1
①该反应的逆反应速率表达式为; V逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
CO浓度(mol·L-1) | H2浓度(mol·L-1) | 逆反应速率(mol·L-1·min-1) |
0.05 | C1 | 4.8 |
c2 | C1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,上述反应的逆反应速率常数k 为__________L3·mol-3·min-1。
②在体积为3L的密闭容器中通入物质的量均为3mol 的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示,则压强Pl_____P2(填“大于”或“小于”)温度T3_______T4(填“大于”或“小于”);压强为P1时,在N点; v正_______v逆(填“大于”或“小于”或“等于”)。求N点对应温度下该反应的平衡常数 K=_____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )
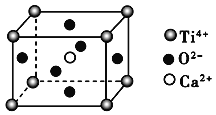
(CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。
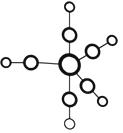
(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。
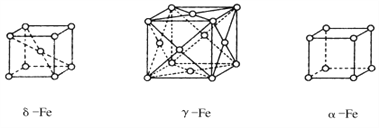
①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池的研究已成为治理和消除环境污染的重要课题,利用微生物电池电解饱和食盐水的工作原理如下图所示。下列说法正确的是
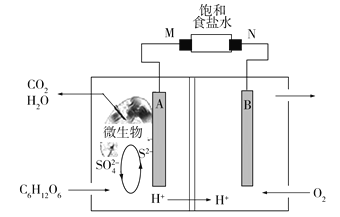
A.电池正极的电极反应:O2+2H2O+4e![]() 4OH
4OH
B.电极M附近产生黄绿色气体
C.若消耗1 mol S2,则电路中转移8 mol e
D.将装置温度升高到60 ℃,一定能提高电池的工作效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AgI可用于人工降雨。AgI溶于水,溶液中离子浓度与温度的关系如图所示,已知:pAg=-lgc(Ag+),pI=-lgc(I-)。下列说法正确的是( )
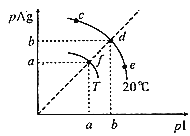
A.图象中,T<20℃
B.AgI的溶度积Ksp(AgI):c=d=e<f
C.20℃时,AgI粉末溶于饱和KI溶液中c(Ag+)=1×10-bmolL-1
D.在d点饱和AgI溶液中加AgNO3粉末,d点移动到f点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com