
【题目】下列关于晶体的说法一定正确的是( )
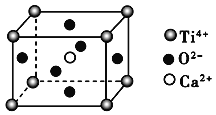
(CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是:

A. b电极上发生氧化反应
B. b电极附近溶液的pH增大
C. a电极反应式:C6H10O5+24e-+7H2O===6CO2↑+24H+
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物的结构简式可进一步简化,如:
(1)根据题目要求回答下列问题:
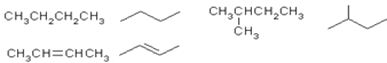
① ![]() 用系统命名法对该有机物进行命名:_____________________________________;该有机物与氢气发生化学反应的化学方程式为(用结构简式书写): ________________________,该有机化学反应的类型是______________________。
用系统命名法对该有机物进行命名:_____________________________________;该有机物与氢气发生化学反应的化学方程式为(用结构简式书写): ________________________,该有机化学反应的类型是______________________。
②  用系统命名法对该有机物进行命名:__________________________________。
用系统命名法对该有机物进行命名:__________________________________。
③ β-月桂烯的结构简式为![]() ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有_________种。
,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有_________种。
(2)下列几种烃类物质:
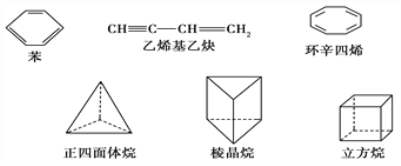
① 正四面体烷的二氯取代产物有______种;立方烷的二氯取代产物有______种。
② 关于苯和环辛四烯的说法正确的是________(填字母符号)。
A.都能使酸性KMnO4溶液褪色
B.都能与H2发生加成反应,等质量的苯和环辛四烯消耗H2的物质的量之比为3:4
C.都是碳碳单键和碳碳双键交替结构
D.都能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的M层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有_______种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为_________。根据等电子原理,AlO2-的空间构型为____________。科学实验证明:通常状态下并不存在NaAlO2 , Al(OH)3溶于强碱溶液形成的阴离子,实际是因为Al(OH)3分子中铝原子最外层电子数未达到饱和 ,能与OH-离子形成配位键,Al(OH)3与碱反应时只能中和1molOH-,表现为一元酸,写出Al(OH)3表现酸性的电离的方程式______________;
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,在Fe(CO)5中铁的化合价为_______,在Fe(CO)5中σ键和π键的数目之比为______。
(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=_____。产生的蓝色沉淀的化学式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣中含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等,为了充分利用资源,一种利用硫铁矿烧渣制绿矾(
等,为了充分利用资源,一种利用硫铁矿烧渣制绿矾(![]() )的化工流程如下:
)的化工流程如下:
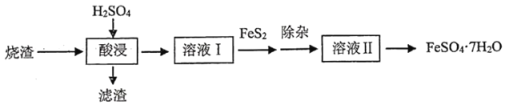
回答下列问题:
(1)酸浸需要使用较浓的硫酸并加热,目的是________________________________,现有![]() ,
,![]() 的硫酸,其物质的量浓度
的硫酸,其物质的量浓度![]() _____________
_____________![]() (保留3位有效数字)。
(保留3位有效数字)。
(2)滤渣除![]() 外,还可能含有__________,溶液Ⅰ需保持
外,还可能含有__________,溶液Ⅰ需保持![]() ,原因是__________。
,原因是__________。
(3)用![]() 还原时,当氧化产物为
还原时,当氧化产物为![]() ,发生主要反应的离子方程式是___________________,检验该反应是否完全发生,所用的试剂是___________________。
,发生主要反应的离子方程式是___________________,检验该反应是否完全发生,所用的试剂是___________________。
(4)除杂时,除去溶液中的![]() ,适宜的物质是_______________。
,适宜的物质是_______________。
A NaOH B H2S C FeS D 氨水
(5)已知![]() ,在不同温度下的溶解度和析出晶体的组成如下表:
,在不同温度下的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 80 | 90 | |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
析出晶体 |
|
|
| |||||||
如要获得![]() ,则需对溶液Ⅱ进行的操作是:蒸发浓缩,___________________,过滤,洗涤,干燥。
,则需对溶液Ⅱ进行的操作是:蒸发浓缩,___________________,过滤,洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数值。下列有关叙述正确的是
为阿伏加德罗常数值。下列有关叙述正确的是
A.标准状况下,5.6LCO2中含有的共用电子对数目为2NA
B.标准状况下,22.4L苯中含有分子的数目为NA
C.1mol![]() 水解生成的
水解生成的![]() 胶体粒子数为NA
胶体粒子数为NA
D.在反应![]() 中,每生成3mol
中,每生成3mol![]() 转移的电子数为
转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)已知FeCl3在反应中得到电子,则该反应的还原剂是__________。
(2)将上述反应设计成的原电池如图所示,请回答下列问题:
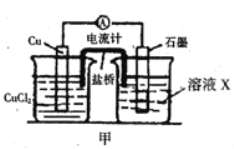
①电解质溶液X是_____;
②Cu电极上发生的电极反应式为_____;
③原电池工作时,盐桥中的___离子(填“K+”或“Cl—”)不断进入X溶液中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1 L水中通入560 L NH3 (已折算为标准状况的体积),从而形成密度为 0.858g·cm-3的氨水(溶质为NH3),求:
(1)560 L氨气的物质的最为________mol。
(2)氨水的质量分数为_____(保留三位有效数字)。
(3)氨水的物质的量浓度_______。(列出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com