
����Ŀ���л�������Ľṹ��ʽ�ɽ�һ�����磺
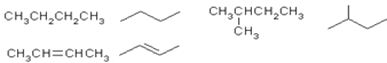
��1��������ĿҪ��ش��������⣺
�� ![]() ��ϵͳ�������Ը��л������������_____________________________________�����л���������������ѧ��Ӧ�Ļ�ѧ����ʽΪ���ýṹ��ʽ��д���� ________________________�����л���ѧ��Ӧ��������______________________��
��ϵͳ�������Ը��л������������_____________________________________�����л���������������ѧ��Ӧ�Ļ�ѧ����ʽΪ���ýṹ��ʽ��д���� ________________________�����л���ѧ��Ӧ��������______________________��
��  ��ϵͳ�������Ը��л������������__________________________________��
��ϵͳ�������Ը��л������������__________________________________��
�� ��-�¹�ϩ�Ľṹ��ʽΪ![]() ��һ���Ӹ��������������巢���ӳɷ�Ӧ�IJ��ֻ����λ���칹�������������_________�֡�
��һ���Ӹ��������������巢���ӳɷ�Ӧ�IJ��ֻ����λ���칹�������������_________�֡�
��2�����м����������ʣ�
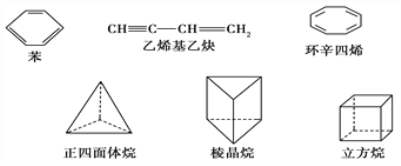
�� ����������Ķ���ȡ��������______�֣�������Ķ���ȡ��������______�֡�
�� ���ڱ��ͻ�����ϩ��˵����ȷ����________(����ĸ����)��
A������ʹ����KMnO4��Һ��ɫ
B��������H2�����ӳɷ�Ӧ���������ı��ͻ�����ϩ����H2�����ʵ���֮��Ϊ3:4
C������̼̼������̼̼˫������ṹ
D�����ܷ���������Ӧ
���𰸡�2-��-1-��ϩ ![]() �ӳɷ�Ӧ 2,2,4,5-�ļ�-3,3-���һ����� 4 1 3 D
�ӳɷ�Ӧ 2,2,4,5-�ļ�-3,3-���һ����� 4 1 3 D
��������
��1����ϩ������ʱ��������̼̼˫����Ϊ4��̼ԭ�ӣ���Ŵ�˫�������һ�˿�ʼ��̼̼˫����1�ź�2��̼ԭ��֮�䣬���������Ϊ2-��-1-��ϩ��̼̼˫�����Ժ����������ӳɷ�Ӧ��������л���������ķ�Ӧ����ʽΪ![]() ����Ӧ�����Ǽӳɷ�Ӧ��
����Ӧ�����Ǽӳɷ�Ӧ��
����������ʱ��������ָ��̼ԭ������࣬��֧������һ������Ŵ�֧�����һ�˿�ʼ����֧�����֮����С����ͼ�� �����������������Ϊ2,2,4,5-�ļ�-3,3-���һ����顣
�����������������Ϊ2,2,4,5-�ļ�-3,3-���һ����顣
�۶��ڷ����ڶ��˫���ļӳɷ�Ӧ������˫�������ᷢ��1,2-�ӳɣ����ڴ��ڼ�λ�Ĺ���˫��Ҳ�ᷢ��1,4-�ӳɡ���-�¹�ϩ����������ӳ���Ҫ�ó�����˫������ôѡ2��˫��1,2-�ӳ���3�ֲ��ͬʱ���Ͻ�����˫��Ϊ����˫����1�����巢��1,4�ӳɣ�������˫������1�����巢��1,2�ӳɣ���1�ֲ������4�֣��ֱ��� ��
�� ��
�� ��
��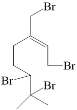 ��
��
��2��������������Ķ���ȡ��������1�֣���ṹ��ʽΪ ��������Ķ���ȡ��������3�֣���ͼ��ʾ��
��������Ķ���ȡ��������3�֣���ͼ��ʾ��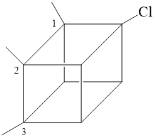 ����
����
��A.������ʹ���Ը��������Һ��ɫ��������ϩ���ԣ�A�����
B.���ͺ�̼̼˫���Ļ�����ϩ���ܺ������ӳɣ�ÿ1mol����3molH2�ӳɣ�ÿ1mol������ϩ��4mol̼̼˫���������4molH2�ӳɣ���������ʵ����ı��ͻ�����ϩ��H2�����ʵ�����Ϊ3��4��B�����
C.������˫�������̼������̼̼������ͬ��C�����
D.������ȼ�գ��ʶ����Է���������Ӧ��D����ȷ��
�ʴ�ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ԭ�����ɶൽ�ٵ�˳����(����)
��24 g̼����0.7 mol NH3����4.6 g�ơ���0.2 mol H2SO4����4 g He
A. �٢ۢڢܢ�B. �ڢ٢ܢݢ�
C. �ڢܢ٢ݢ�D. �ܢݢڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25 ��ʱ����������ʵĵ���ƽ�ⳣ�����±���ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO | |
ƽ�ⳣ�� | Ka=1.8��10-5 | Ka1=4.3��10-7 | Ka2=5.6��10-11 | Ka=3.0��10-8 |
�ش��������⣺
��1�����ʵ���Ũ�Ⱦ�Ϊ0.1 mol��L-1��������Һ��
a. CH3COOH������ b. H2CO3 c. NaHCO3 d. HClO
pH��С���������˳����____(����ĸ)��
��2�������£�0.1 mol��L-1CH3COOH��Һ��ˮϡ�����У����б���ʽ����ֵ������____(����ĸ)��
A. c(H+) B.![]() C. c(H+)��c(OH-) D.
C. c(H+)��c(OH-) D.![]() E.
E.![]()
��3�������Ϊ100 mL��pH=2��CH3COOH��һԪ��HX����ˮϡ������pH����Һ����Ĺ�ϵ����ͼ��ʾ����HX�ĵ���ƽ�ⳣ��____(����ڡ�����С�ڡ����ڡ�)CH3COOH�ĵ���ƽ�ⳣ����������____�������������pH����ͬ��CH3COOH��һԪ��HX�м���������п�����ɵ���������ͬ����������С��ϵΪ��CH3COOH____(����ڡ�����С�ڡ����ڡ�)HX

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2NaHCO3![]() Na2CO3 + H2O+CO2 ���ְ�14.8g Na2CO310H2O��NaHCO3��ɵĹ�����������ˮ���100mL��Һ������c��Na+��=1.2molL��1�����ѵ������Ĺ���������������أ��������������ǣ��� ��
Na2CO3 + H2O+CO2 ���ְ�14.8g Na2CO310H2O��NaHCO3��ɵĹ�����������ˮ���100mL��Һ������c��Na+��=1.2molL��1�����ѵ������Ĺ���������������أ��������������ǣ��� ��
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮFeCl3���غ�ɫ�����׳��⣬100 ������ʱ��������ҵ�ϳ������л��ϳɴ�����ʵ���ҿ�������װ��(�г�������ȥ)�Ʊ����ռ���ˮFeCl3��
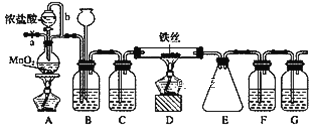
��1��װ��A�з�Ӧ�����ӷ���ʽΪ________________��
��2��װ��C�����ӵ��Լ�Ϊ____________��
��3������b������Ϊ___________��װ��G������Ϊ________��
��4��ʵ��ʱӦ�ȵ�ȼA���ľƾ��ƣ���Ӧһ������ٵ�ȼD���ľƾ��ƣ�����Ϊ_____��
��5��Ϊ�������ò�ƷΪFeCl3���ɽ�������ʵ�飺ȡE���ռ��IJ�����������ˮ�ܽ⣬��������Һ�м���____________��___________(���Լ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pKa=��lgKa��25��ʱ�����������pKaֵ���±���ʾ������˵����ȷ����
����Ļ�ѧʽ | CH3COOH | HCOOH | H2SO3 |
pKa | 4.74 | 3.74 | 1.90 7.20 |
A. ��Na2SO3��Һ�м���������ᣬ��Ӧ����SO2
B. 25��ʱ��pH=8�ļ�������Һ�У�c( HCOOH)=9.9��10��7mol��L-1
C. 25��ʱ��ij������ҺpH=a�����Ũ�ȵļ���pH=a��1
D. ��ͬ�¶��£���Ũ�ȵ� HCOONa��Һ��Na2SO3��Һ��pH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪XΪFe2O3��CuO�Ļ������������ǿ��˳��Fe3��>Cu2��>H��>Fe2����X��Ʒ�ɷ�����ͼ��ʾ��ת����ϵ��
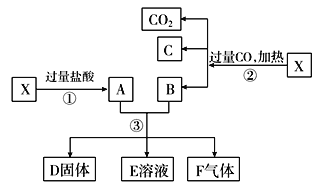
(1)д������ۿ��ܷ�����Ӧ�����ӷ���ʽ��________________________(����3������дһ������)��
(2)����ҺE��ֻ��һ�ֽ������ӣ���һ����__________������ҺE�к������ֽ������ӣ���һ����________��
(3)��D�����Ǵ�����ù�����________(�ѧʽ)��
(4)ӡˢ��·�����ɸ߷��Ӳ��Ϻ�ͭ�����϶��ɵģ�����FeCl3��Һ������ʴ��������ӡˢ��·�壬�ù��̷�����Ӧ�����ӷ���ʽΪ____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ھ����˵��һ����ȷ���ǣ�������
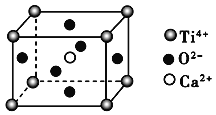
(CaTiO3�ľ���ṹģ��(Ca2����O2����Ti4���ֱ�λ������������ġ����ĺͶ���)
A. ���Ӿ����ж����ڹ��ۼ�
B. CaTiO3������ÿ��Ti4����12��O2�������
C. SiO2������ÿ����ԭ����������ԭ���Թ��ۼ�����
D. ����������۵㶼�ȷ��Ӿ�����۵��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�������������ϵ����ʲ��ϱ仯�������ijɷ�Ҳ�����˺ܴ�ı仯���±���ԭʼ������Ŀǰ��������Ҫ�ɷ֣�

���ϱ����漰�ķ�����д���пհס�
��1������10�����ӵķ�����(�ѧʽ����ͬ)______________��
��2���ɼ��Լ����ɵķǼ��Է�����____________________��
��3����H����ֱ���γ���λ���ķ�����________��
��4���е���ߵ�������________������ѧ��֪ʶ������е���ߵ�ԭ��________��
��5�������в����µ��ӶԵķ���(ϡ���������)��________���������幹��Ϊ________��
��6����������ˮ����ˮ��Һ�ʼ��Ե����ʵķ�����________����֮���Լ�������ˮ����Ϊ���ķ��Ӻ�ˮ����֮���γ�________��
��7��CO�Ľṹ�ɱ�ʾΪO![]() C����CO�ṹ�����Ƶķ�����________�������ֽṹ���Ƶķ����У����ӵļ���________(���ͬ������ͬ��)��CO��������һ�������γ���������������ͬ������________��
C����CO�ṹ�����Ƶķ�����________�������ֽṹ���Ƶķ����У����ӵļ���________(���ͬ������ͬ��)��CO��������һ�������γ���������������ͬ������________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com