
����Ŀ����������������������Ź㷺����;����ش��������⡣
(1)Fe2+��M������Ų�ʽ____________��Ԫ��Fe��Mn�ĵ��������ֱܷ�ΪI3(Fe)��I3(Mn)����I3(Fe)______I3(Mn)(����>������<")��
(2)���������У���Alԭ��δ�ɶԵ�������ͬ�Ľ���Ԫ����_______�֡���̬�Ȼ����ķ������Ϊ(AlCl3)2������Al��Cl����8e-�ȶ��ṹ��Alԭ�ӵ��ӻ���ʽΪ_________�����ݵȵ���ԭ����AlO2���Ŀռ乹��Ϊ____________����ѧʵ��֤����ͨ��״̬�²�������NaAlO2 �� Al(OH)3����ǿ����Һ�γɵ������ӣ�ʵ������ΪAl(OH)3��������ԭ������������δ�ﵽ���� ������OH�������γ���λ����Al(OH)3��Ӧʱֻ���к�1molOH��,����ΪһԪ�ᣬд��Al(OH)3�������Եĵ���ķ���ʽ______________��
(3)Fe(CO)5���۵�Ϊ-20�棬�е�Ϊ103�棬���������ѣ���Fe(CO)5�����Ļ��ϼ�Ϊ_______����Fe(CO)5����������������Ŀ֮��Ϊ______����
(4)��λ������K3[Fe(CN)n]���������ӻ������ɫ��������˿����ڼ����������ӣ���֪��ԭ�ӵ������������������ṩ������֮��Ϊ14����n=_____����������ɫ�����Ļ�ѧʽ____________��
���𰸡�3s23p63d6 < 4 sp3 ֱ���� Al(OH)3 + H2O ![]() [Al(OH)4]��+ H+ 0 1:1 6 Fe3 [Fe(CN)6]2
[Al(OH)4]��+ H+ 0 1:1 6 Fe3 [Fe(CN)6]2
��������
��1��Fe��ԭ������Ϊ26����̬Fe2+�ĵ���Ϊ24����Mn2+ת��ΪMn3+ʱ��3d�ܼ��ɽ��ȶ���3d5�����״̬תΪ���ȶ���3d4״̬����Fe2+��Fe3+ʱ��3d�ܼ��ɲ��ȶ���3d6���ȶ���3d5�����״̬��
��2��Alԭ��δ�ɶԵ�����Ϊ1����AlCl3��2��������������4����λ�������ӳɼ�������3��Ϊ���ۼ���һ��Ϊ��λ������AlO2����CO2��ԭ�Ӹ�����Ϊ3,�۵�������Ϊ16����Ϊ�ȵ����壻��������������ʽ����ʱ����ˮ��������������γ���λ�������[Al(OH)4]����ʹ��Һ�����ԣ�
��3��Fe��CO��5����Ԫ�صĻ��ϼ�Ϊ0�ۣ�Fe(CO)5��CO����ԭ��֮����5��������ÿ��CO��������1��������2��������
��4������λ������K3[Fe��CN��n]��ÿ����������ṩһ�Ե��ӣ�����ԭ���������2�����ӣ�����ԭ�ӵ������������������ṩ������֮��Ϊ14���ɵ�2+2n=14��
��1��Fe��ԭ������Ϊ26����̬Fe2+�ĵ���Ϊ24��������Ų�ʽΪ1s22s22p63s23p63d6����Mn2+ת��ΪMn3+ʱ��3d�ܼ��ɽ��ȶ���3d5�����״̬תΪ���ȶ���3d4״̬��Ҫ�������϶ࣻ��Fe2+��Fe3+ʱ��3d�ܼ��ɲ��ȶ���3d6���ȶ���3d5�����״̬����Ҫ���������Ҫ�٣��ʴ�Ϊ��3s23p63d6��<��
��2��Alԭ��δ�ɶԵ�����Ϊ1���������ڸ�����Ԫ���У�δ�ɶԵ�����ҲΪ1����K��Sc��Cu��Ga������4�֣���̬�Ȼ������Ϊ�����壨AlCl3��2������Al��Cl����8e-�ȶ��ṹ��˵����������������4����λ�������ӳɼ�������3��Ϊ���ۼ���һ��Ϊ��λ����Alԭ�ӵ��ӻ���ʽΪsp3�ӻ���AlO2����CO2��ԭ�Ӹ�����Ϊ3,�۵�������Ϊ16����Ϊ�ȵ����壬CO2�Ŀռ乹��Ϊֱ���Σ���AlO2���Ŀռ乹��Ϊֱ���Σ���Al(OH)3��������ԭ������������δ�ﵽ���� ������OH�������γ���λ����Al(OH)3��Ӧʱֻ���к�1molOH��������ΪһԪ���֪����������������ʽ����ʱ����ˮ��������������γ���λ�������[Al(OH)4]����ʹ��Һ�����ԣ����뷽��ʽΪAl(OH)3 + H2O ![]() [Al(OH)4]��+ H+���ʴ�Ϊ��4��sp3�ӻ���ֱ���Σ�Al(OH)3 + H2O
[Al(OH)4]��+ H+���ʴ�Ϊ��4��sp3�ӻ���ֱ���Σ�Al(OH)3 + H2O ![]() [Al(OH)4]��+ H+��
[Al(OH)4]��+ H+��
��3��Fe��CO��5����Ԫ�صĻ��ϼ�Ϊ0�ۣ�Fe(CO)5��CO����ԭ��֮����5��������ÿ��CO��������1��������2��������Fe(CO)5������Ϊ10��,����Ϊ10����������������Ŀ֮��Ϊ1:1���ʴ�Ϊ��0��1:1��
��4������λ������K3[Fe��CN��n]��ÿ����������ṩһ�Ե��ӣ�����ԭ���������2�����ӣ�����ԭ�ӵ������������������ṩ������֮��Ϊ14���ɵ�2+2n=14������n=6��K3[Fe��CN��6]���������ӷ�Ӧ����Fe3 [Fe(CN)6]2��ɫ�������ʴ�Ϊ��6��Fe3[Fe(CN)6]2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������

��1����ˮ�������ɺ�ˮ��õ�ˮ�ij��÷���֮һ����ʵ���������һ������װ�ÿ϶� ��Ҫ���������е�һ���֣�����ʵ���������µ��ϡ������ҵ�˳��������__________ ������ţ���������������ˮӦ��________������a������b�����ڽ��롣
��2���������������ʾ����������Եõ���ˮ�����ӵ�ˮ����ȡ�⣬��Ҫ�������� �е�______������ţ�������������Ϊ__________����õ�ˮ�м������Ȼ�̼����ȡ�� ���ʵ�ʵ���������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮFeCl3���غ�ɫ�����׳��⣬100 ������ʱ��������ҵ�ϳ������л��ϳɴ�����ʵ���ҿ�������װ��(�г�������ȥ)�Ʊ����ռ���ˮFeCl3��
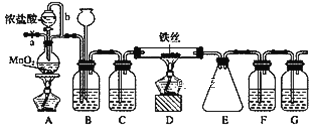
��1��װ��A�з�Ӧ�����ӷ���ʽΪ________________��
��2��װ��C�����ӵ��Լ�Ϊ____________��
��3������b������Ϊ___________��װ��G������Ϊ________��
��4��ʵ��ʱӦ�ȵ�ȼA���ľƾ��ƣ���Ӧһ������ٵ�ȼD���ľƾ��ƣ�����Ϊ_____��
��5��Ϊ�������ò�ƷΪFeCl3���ɽ�������ʵ�飺ȡE���ռ��IJ�����������ˮ�ܽ⣬��������Һ�м���____________��___________(���Լ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪XΪFe2O3��CuO�Ļ������������ǿ��˳��Fe3��>Cu2��>H��>Fe2����X��Ʒ�ɷ�����ͼ��ʾ��ת����ϵ��
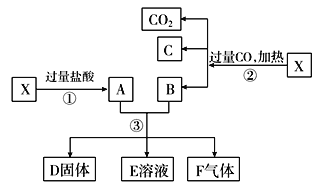
(1)д������ۿ��ܷ�����Ӧ�����ӷ���ʽ��________________________(����3������дһ������)��
(2)����ҺE��ֻ��һ�ֽ������ӣ���һ����__________������ҺE�к������ֽ������ӣ���һ����________��
(3)��D�����Ǵ�����ù�����________(�ѧʽ)��
(4)ӡˢ��·�����ɸ߷��Ӳ��Ϻ�ͭ�����϶��ɵģ�����FeCl3��Һ������ʴ��������ӡˢ��·�壬�ù��̷�����Ӧ�����ӷ���ʽΪ____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���� ( )
A. AlCl3��Һ�еμӹ���NH3��H2O��Al3+ + 4OH-= AlO2-+ 2H2O
B. ����ˮ�ķ�Ӧ��Na+2 H2O =Na++2OH-+H2��
C. NaHSO4��Һ�м�BaCl2��Һ��SO42-+Ba2+=BaSO4��
D. ������ˮ�ķ�Ӧ��Cl2 + H2O = 2 H+ + ClO-+ Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ھ����˵��һ����ȷ���ǣ�������
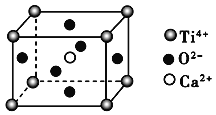
(CaTiO3�ľ���ṹģ��(Ca2����O2����Ti4���ֱ�λ������������ġ����ĺͶ���)
A. ���Ӿ����ж����ڹ��ۼ�
B. CaTiO3������ÿ��Ti4����12��O2�������
C. SiO2������ÿ����ԭ����������ԭ���Թ��ۼ�����
D. ����������۵㶼�ȷ��Ӿ�����۵��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�35.5g�����������___L��������������ȫ���������Ȼ�������ʵ�����___mol�������ɵ������Ƴ�1L��Һ�����ʵ����ʵ���Ũ����___mol/L��������Һȡ��20mL������ˮϡ�ͳ�200mL��Һ����ϡϡ�����Һ�����ʵ����ʵ���Ũ����___mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ե�ؾ��������ŵ��������ص㣬����õ��㷺Ӧ�ã�п���̼��Ե��������������ҺΪ���Һ������ܷ�ӦʽΪ��Zn��s��+2MnO2��s��+H2O��l��![]() Zn��OH��2��s��+Mn2O3��s�� ����˵��������ǣ� ��
Zn��OH��2��s��+Mn2O3��s�� ����˵��������ǣ� ��
A. ��ع���ʱ��пʧȥ����
B. ��������ĵ缫��ӦʽΪ��2MnO2��s��+H2O��1��+2e��=Mn2O3��s��+2OH����aq��
C. ��ع���ʱ������������ͨ�����·����
D. ���·��ÿͨ��0.2mol���ӣ�п�����������ϼ�С6.5g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������A������ͼ��������Է�������Ϊ84��������ױ��������к���̼̼˫�����˴Ź����ױ���������ֻ��һ�����͵��⣮
(1)A�Ľṹ��ʽΪ___________�� A�е�̼ԭ���Ƿ���ͬһƽ�棿____(������������������)��
(2) ����ͼ�У�D1��D2��Ϊͬ���칹�壬E1��E2��Ϊͬ���칹�壮

��Ӧ�ڵĻ�ѧ����ʽΪ__________________________��E2�Ľṹ��ʽ��___________________���ܡ��ķ�Ӧ����������________________________��__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com