
【题目】下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3molO2和0.3molH2O
B.![]() 个
个![]() 与0.1molKMnO4
与0.1molKMnO4
C.0.1molCuSO4﹒H2O和0.1molC6H12O6
D.0.1molH2SO4和0.4NA个H2O
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)小苏打可用于中和过多的胃酸,该反应的离子方程式为:___。
(2)向蔗糖中加入浓硫酸时,蔗糖变黑,体积膨胀,变成海绵状的炭。蔗糖变黑,说明浓硫酸具有__性,后产生有刺激性气味的气体,说明浓硫酸具有___性。
(3)NO2是___色的有毒气体,它与水反应的化学方程式为___,该反应中氧化剂与还原剂的质量比为___。
(4)用10mol·L-1H2SO4配制480mL1mol·L-1H2SO4,有如下几个操作:
①计算并用量筒量取___mL10mol·L-1H2SO4稀释。
②配制溶液所用到的玻璃仪器除烧杯、玻璃棒外,还必须有__、__![]() 填仪器名称
填仪器名称![]() 。
。
③下列操作可能使所配溶液浓度偏小的是__![]() 填写序号
填写序号![]() 。
。
A.未洗涤烧杯和玻璃棒
B.定容时俯视容量瓶的刻度线
C.配溶液前容量瓶中有少量蒸馏水
D.摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
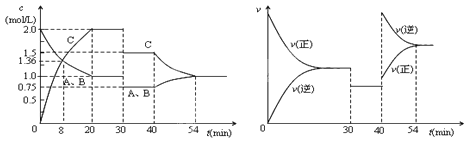
A.前8min A的平均反应速率为0.08mol/(L·s)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.1molCH4 的质量为__________,分子数为__________(用NA表示,下同),原子总数为_________。
(2)500 mL 0.2 mol·L-1的Ba(NO3)2溶液中,NO3-的物质的量的浓度为______________,离子总数为_____________。
(3)在22 .2g某二价金属的氯化物中含有0 .4mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为__________。
(4)在标准状况下,由O2和O3组成的混合气体11.2 L,质量为20g。此混合物的平均摩尔质量是________,混合物中O2和O3的体积之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列两个热化学方程式,回答下列问题:
2H2(g)+O2(g)![]() 2H2O(1) ΔH=571.6 kJ · mol1
2H2O(1) ΔH=571.6 kJ · mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
(1)H2的燃烧热为_______,C3H8的燃烧热为_______。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(3)现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,可完成高温下铁与水蒸气反应的实验。
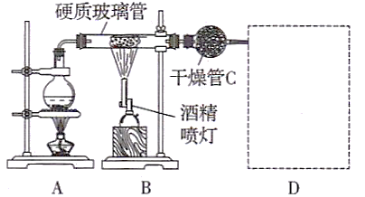
(1)写出有关反应的化学方程式:__________________________。
(2)装置C作用是__________________________。
(3)圆底烧瓶中盛装的是水,该装置的主要作用是_______________;圆底烧瓶底部放了几片碎瓷片,碎瓷片的作用是______________________。
(4)实验开始时应先点燃________________。(填A或B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为__________molL-1。若从中取出50 mL,其物质的量浓度为__________ molL-1。若将这50 mL溶液用水稀释到100 mL,所得溶液中![]() 的物质的量浓度为__________ molL-1,
的物质的量浓度为__________ molL-1,![]() 的物质的量浓度为__________ molL-1。
的物质的量浓度为__________ molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究Cu和H2O2的反应。
(猜想预测)
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
(实验探究)
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10 小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________。
(继续探究)
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2+ + 4NH3 [ Cu(NH3)4] 2+ ,[ Cu(NH3)4] 2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
装置 | 序号 | 试剂a | 现象 |
| ⅱ | 20 mL 30% H2O与4 mL 5 mol/L H2SO4 混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是________(用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
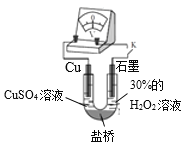
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,2mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g) ΔH<0,经20s达到平衡,生成0.5mol Z。下列说法正确的是
Z(g) ΔH<0,经20s达到平衡,生成0.5mol Z。下列说法正确的是
A.该反应平衡常数的值为1
B.将容器体积变为20L,Z的平衡浓度减小为0.025mol/L
C.以X浓度变化表示的反应速率为0.005mol/(L·s)
D.当X、Y、Z的浓度相等时,证明反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com