
【题目】请按要求回答下列问题:
(1)小苏打可用于中和过多的胃酸,该反应的离子方程式为:___。
(2)向蔗糖中加入浓硫酸时,蔗糖变黑,体积膨胀,变成海绵状的炭。蔗糖变黑,说明浓硫酸具有__性,后产生有刺激性气味的气体,说明浓硫酸具有___性。
(3)NO2是___色的有毒气体,它与水反应的化学方程式为___,该反应中氧化剂与还原剂的质量比为___。
(4)用10mol·L-1H2SO4配制480mL1mol·L-1H2SO4,有如下几个操作:
①计算并用量筒量取___mL10mol·L-1H2SO4稀释。
②配制溶液所用到的玻璃仪器除烧杯、玻璃棒外,还必须有__、__![]() 填仪器名称
填仪器名称![]() 。
。
③下列操作可能使所配溶液浓度偏小的是__![]() 填写序号
填写序号![]() 。
。
A.未洗涤烧杯和玻璃棒
B.定容时俯视容量瓶的刻度线
C.配溶液前容量瓶中有少量蒸馏水
D.摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
【答案】H++HCO3-=CO2↑+H2O 脱水 强氧化 红棕 3NO2+H2O=2HNO3+NO 1:2 50.0 500mL容量瓶 胶头滴管 AD
【解析】
(1)盐酸与碳酸氢钠反应生成氯化钠、二氧化碳和水;
(2)依据蔗糖遇到浓硫酸脱水碳化,生成的碳被浓硫酸氧化生成二氧化碳,浓硫酸被还原为二氧化硫解答;
(3)二氧化氮为红棕色固体,与水反应生成硝酸和一氧化氮,分析反应中元素化合价变化,判断氧化剂还原剂及物质的量之比;
(4) ①容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,据此选择容量瓶规格,依据浓硫酸体积选择量筒规格;②配制溶液所用到的玻璃仪器除烧杯、玻璃棒、容量瓶、胶头滴管,据此分析;③根据![]() ,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
(1)盐酸与碳酸氢钠反应生成氯化钠、二氧化碳和水,离子方程式:H++HCO3-=CO2↑+H2O;
故答案为:H++HCO3-=CO2↑+H2O;
(2)向蔗糖中加入浓硫酸时,蔗糖变黑,体积膨胀,变成海绵状的炭。蔗糖变黑,说明浓硫酸具有脱水性,后产生有刺激性气味的气体,说明浓硫酸具有强氧化性;
故答案为:脱水;强氧化;
(3)二氧化氮为红棕色固体,与水反应生成硝酸和一氧化氮,方程式:3NO2+H2O=2HNO3+NO,反应中3mol二氧化氮参加反应,2mol二氧化氮中氮元素化合价升高,1mol二氧化氮中氮元素化合价降低,所以依据方程式,3mol二氧化氮参加反应,1mol做氧化剂,2mol做还原剂,二者物质的量之比为1:2,则二者的质量之比为1:2;
故答案为:红棕; 3NO2+H2O=2HNO3+NO;1:2;
(4)①由于无480mL的容量瓶,故应选用500mL的容量瓶,配制出500mL1mol/L的溶液, 根据溶液稀释定律C浓·V浓=C稀·V稀可知:1mol/L×500mL=10mol/L×XmL,解得X=50.0mL;
故答案为:50.0;500mL容量瓶;
②配制溶液所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管、容量瓶,由于无480mL的容量瓶,故应选用500mL的容量瓶,
故答案为:500mL容量瓶,胶头滴管;
③根据![]() ,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
A.未洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,则所配溶液的浓度偏低,A项正确;
B.定容时俯视容量瓶的刻度线,导致溶液体积偏小,则所配溶液的浓度偏高,B项错误;
C.定容时还需加入蒸馏水,因此配溶液前容量瓶中有少量蒸馏水并不影响配制溶液浓度,C项错误;
D.摇匀后,容量瓶壁沾有少量水,因此发现液面低于刻度线属于正常现象,继续加水至凹液面与刻度线相切,则导致导致溶液体积偏大,则所配溶液的浓度偏低,D项正确;
故答案为:AD。


科目:高中化学 来源: 题型:
【题目】已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。
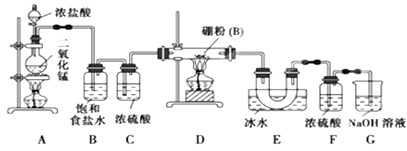
回答下列问题:
(1)写出装置A中发生反应的离子方程式________________。
(2)写出装置D中发生反应的化学方程式为_____________________。
(3)装置B、E的作用分别是________________、________________。
(4)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式:
(1)实验室可以用KClO3和浓盐酸反应制取氯气,写出发生反应的化学方程式并用双线桥表示电子转移方向和数目_____________。
(2)二氧化氯(ClO2)作为一种高效强氧化剂,可用KClO3和草酸(H2C2O4),稀硫酸,水浴加热制备。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为________________。
(3)写出工业上制备漂白粉的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO(g)![]() N2(g)+O2(g) △H=-181.5 kJ/mol。某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
N2(g)+O2(g) △H=-181.5 kJ/mol。某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
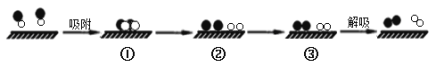
A.①B.②C.③D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯(![]() ,
,![]() )是一种重要的有机化工原料,可用环成二烯(
)是一种重要的有机化工原料,可用环成二烯(![]() ,
,![]() )制备。已知:
)制备。已知:
反应Ⅰ ![]()
![]()
反应Ⅱ ![]() (环戊烷)
(环戊烷) ![]()
反应Ⅲ ![]()
![]()
![]()
(1)某温度下,将环戊二烯和HI按物质的量之比1∶2(总物质的量为amol)充入容积为2L的恒容密闭容器中,发生反应:![]() 。
。
①该反应自发进行的条件是__________。
②下列有关该反应的叙述,不正确的是__________。
A.气体压强不变,说明反应达到平衡状态
B.升高温度,有利于提高环戊烯的产率
C.反应达到平衡时,C5H6和HI的转化率相等
D.通入惰性气体,有利于提高环戊二烯的平衡转化率
(2)以![]() 为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
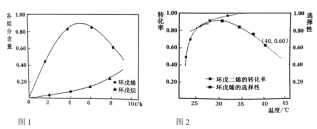
①环成二烯氢化制环成烯的最佳反应温度为__________,选择该温度的原因是__________。
②升高温度,环戊二烯转化率提高而环戊烯选择性降低,其原因是__________。
③在图1中画出40℃时环戊烯含量随t变化趋势的曲线。__________
(3)实际生产中,常由双环戊二烯通入水蒸气解聚成环戊二烯:

某温度,加入总压为70kPa的双环成二烯和水蒸气,达到平衡后总压为110kPa,双环戊二烯的转化率为80%,则该反应的平衡常数![]() __________(对于气相反应,用某组分B的平衡压强
__________(对于气相反应,用某组分B的平衡压强![]() 代替物质的量浓度
代替物质的量浓度![]() 也可表示平衡常数,记作
也可表示平衡常数,记作![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1 mol气体A和1 mol气体B充入2 L某密闭容器中,发生反应:![]() ,
,![]() 时达到平衡。在
时达到平衡。在![]() 、
、![]() 时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化的曲线如图所示。下列说法正确的是( )
时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化的曲线如图所示。下列说法正确的是( )
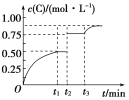
A.![]() 时改变的条件是使用催化剂
时改变的条件是使用催化剂
B.反应的化学方程式中,![]()
C.![]() 间该反应的平衡常数均为5
间该反应的平衡常数均为5
D.![]() 时改变的条件是移去少量物质D
时改变的条件是移去少量物质D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼铅烟尘的主要成分为铅的氧化物(Pb2O3、Pb3O4、PbO)及PbSO4,其杂质主要为含镉(Cd)化合物,回收处理炼铅烟尘可实现资源再生。某工艺流程如图:
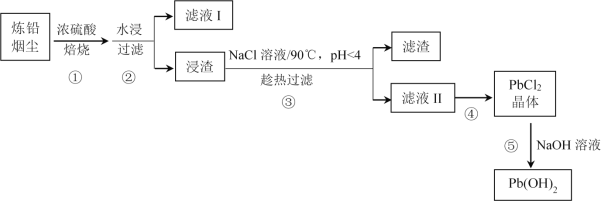
已知:ⅰ.Pb2O3![]() Pb3O4
Pb3O4![]() PbO
PbO
ⅱ.CdSO4易溶于水,热稳定性好
ⅲ.PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)
PbCl2(s)+SO42-(aq)
PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
ⅳ.Pb(OH)2为两性氢氧化物
(1)步骤①中焙烧的目的是________。在此过程中PbO与浓硫酸发生反应的化学方程式为________。
(2)滤液I的成分是________。
(3)相同反应时间,步骤①中焙烧温度和酸料比对Pb、Cd去除率的影响如下表所示(均未达到平衡状态)。
焙烧温度/℃ | 各元素的去除率/% | 酸料比/(mL/g) | 各元素的去除率/% | ||
Pb | Cd | Pb | Cd | ||
100 | 2.57 | 56.63 | 0.3 | 2.57 | 74.12 |
200 | 2.62 | 89.30 | 0.4 | 2.67 | 85.10 |
500 | 2.67 | 96.98 | 0.5 | 2.72 | 92.48 |
600 | 2.87 | 95.42 | 0.6 | 2.67 | 96.98 |
900 | 2.88 | 40.15 | 0.7 | 2.65 | 95.13 |
应选择的焙烧温度和酸料比为________。
Cd去除率随温度升高先增大后减小的原因可能为________。
(4)步骤③中NaCl溶液的作用是________。
(5)步骤④的操作是________。
(6)下列说法正确的是________(填序号)。
A.步骤①中浓硫酸作氧化剂
B.步骤③中pH<4的目的是防止Pb2+水解
C.步骤④的滤液可循环利用以提高Pb的回收率
D.步骤⑤中增大NaOH溶液浓度可使Pb沉淀完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由核电荷数1~18的某些元素组成的单质 A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示的转换关系,A是地壳中含量最多的金属元素。 请回答下列问题:
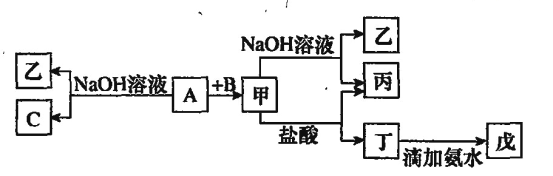
(1)写出下列物质的化学式:乙__________、丁__________、戊__________.
(2)写出甲物质在工业上的一种主要用途:__________。
(3)写出甲→乙+丙反应的离子方程式:__________。
(4)A→乙+C反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3molO2和0.3molH2O
B.![]() 个
个![]() 与0.1molKMnO4
与0.1molKMnO4
C.0.1molCuSO4﹒H2O和0.1molC6H12O6
D.0.1molH2SO4和0.4NA个H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com