
【题目】环戊烯(![]() ,
,![]() )是一种重要的有机化工原料,可用环成二烯(
)是一种重要的有机化工原料,可用环成二烯(![]() ,
,![]() )制备。已知:
)制备。已知:
反应Ⅰ ![]()
![]()
反应Ⅱ ![]() (环戊烷)
(环戊烷) ![]()
反应Ⅲ ![]()
![]()
![]()
(1)某温度下,将环戊二烯和HI按物质的量之比1∶2(总物质的量为amol)充入容积为2L的恒容密闭容器中,发生反应:![]() 。
。
①该反应自发进行的条件是__________。
②下列有关该反应的叙述,不正确的是__________。
A.气体压强不变,说明反应达到平衡状态
B.升高温度,有利于提高环戊烯的产率
C.反应达到平衡时,C5H6和HI的转化率相等
D.通入惰性气体,有利于提高环戊二烯的平衡转化率
(2)以![]() 为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
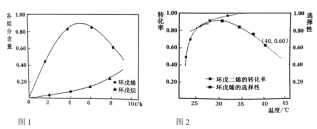
①环成二烯氢化制环成烯的最佳反应温度为__________,选择该温度的原因是__________。
②升高温度,环戊二烯转化率提高而环戊烯选择性降低,其原因是__________。
③在图1中画出40℃时环戊烯含量随t变化趋势的曲线。__________
(3)实际生产中,常由双环戊二烯通入水蒸气解聚成环戊二烯:

某温度,加入总压为70kPa的双环成二烯和水蒸气,达到平衡后总压为110kPa,双环戊二烯的转化率为80%,则该反应的平衡常数![]() __________(对于气相反应,用某组分B的平衡压强
__________(对于气相反应,用某组分B的平衡压强![]() 代替物质的量浓度
代替物质的量浓度![]() 也可表示平衡常数,记作
也可表示平衡常数,记作![]() )。
)。
【答案】低温 BD 30℃ 该温度下,催化剂的活性好且选择性好 温度升高,反应Ⅰ和反应Ⅱ的反应速率都加快,但对反应Ⅱ速率的影响大于反应Ⅰ 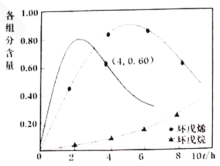 640
640
【解析】
(1)反应Ⅰ:![]()
![]()
反应Ⅲ:![]()
![]()
反应Ⅰ-反应Ⅲ得:![]() ,其
,其![]()
![]() =
=![]() 。
。
①该反应的![]()
![]() <0,
<0,![]() <0,当
<0,当![]() -T·
-T·![]() <0时,反应自发进行,即T很小(低温)时,该反应自发进行,故答案为:低温;
<0时,反应自发进行,即T很小(低温)时,该反应自发进行,故答案为:低温;
②A.恒容时,正反应是气体压强减小的反应,当气体压强不变,说明反应达到平衡状态,A正确;
B.正反应是放热反应,升高温度,平衡逆向移动,环戊烯的产率下降,B错误;
C.起始时,环戊二烯和HI按物质的量之比1∶2,则二者转化率之比=![]() =1:1,即反应达到平衡时,C5H6和HI的转化率相等,C正确;
=1:1,即反应达到平衡时,C5H6和HI的转化率相等,C正确;
D.恒容,通入惰性气体,平衡不发生移动,环戊二烯的平衡转化率不变,D错误;
故答案为:BD;
(2)①由图2可知,30℃时,环戊烯的选择性最大且环戊二烯的转化率较高(催化剂活性好),所以,30℃是环戊二烯氢化制环戊烯的最佳反应温度,故答案为:30℃;该温度下,催化剂的活性好且选择性好;
②温度升高,反应Ⅰ和反应Ⅱ的反应速率都加快,但对反应Ⅱ速率的影响大于反应Ⅰ,所以出现升高温度,环戊二烯转化率提高而环戊烯选择性降低,故答案为:温度升高,反应Ⅰ和反应Ⅱ的反应速率都加快,但对反应Ⅱ速率的影响大于反应Ⅰ;
③40℃时,反应速率加快,环戊烯含量达到较高值的时间缩短,且因环戊烯的选择性降低导致环戊烯含量最大值减小,结合选择性公式可知,40℃,4h时,环戊烯和环戊烷的含量比应为0.6:0.4,所以,40℃时环戊烯含量随t变化趋势的曲线如图所示: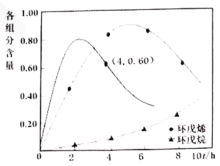 ,故答案为:
,故答案为: ;
;
(3)设双环戊二烯的起始分压为p,水蒸气分压为p0,则到达平衡后双环戊二烯分压减小了0.8p,双环戊二烯的分子式为:C10H12,故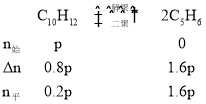 ,p+p0=70kPa,0.2p+1.6p+p0=1.8p+p0=110kPa,解得:p=50kPa,所以:
,p+p0=70kPa,0.2p+1.6p+p0=1.8p+p0=110kPa,解得:p=50kPa,所以:![]() =640/span>,故答案为:640。
=640/span>,故答案为:640。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中pH和pOH的关系如图所示,已知pH=-lgc(H+),pOH=-lgc(OH-)。下列说法一定正确的是( )

A.水的电离程度,B>A>D
B.lmolL-1Na2SO4溶液不可能处于B点
C.向C点水溶液中通入HCl,则C点变为E点
D.0.1molL-1NaHA溶液的pH和pOH的关系如图中E点所示,此时溶液中离子的物质的量浓度关系:c(HA-)>c(A2-)>c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应的能量变化如图所示。下列说法正确的是

A.在通常状况下,金刚石比石墨更稳定
B.石墨的燃烧热为![]()
C.
![]()
D.12g石墨在一定量的空气中燃烧,生成气体产物36g,该过程放出的热量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在人类的生产和生活中有着广泛的应用,某化学兴趣小组利用图一装置探究氨气的有关性质。
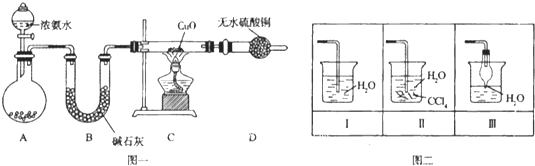
(1)装置A中烧瓶内试剂可选用 (填序号)。B的作用是
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 ,.该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑色固体A加热至红热投入到无色溶液B中发生如图转化关系。

(1)由此可以推断:A为________(填化学式,下同),B为_______,X为_______,C为_________,E为_________。
(2)写出A与B反应的化学方程式: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)小苏打可用于中和过多的胃酸,该反应的离子方程式为:___。
(2)向蔗糖中加入浓硫酸时,蔗糖变黑,体积膨胀,变成海绵状的炭。蔗糖变黑,说明浓硫酸具有__性,后产生有刺激性气味的气体,说明浓硫酸具有___性。
(3)NO2是___色的有毒气体,它与水反应的化学方程式为___,该反应中氧化剂与还原剂的质量比为___。
(4)用10mol·L-1H2SO4配制480mL1mol·L-1H2SO4,有如下几个操作:
①计算并用量筒量取___mL10mol·L-1H2SO4稀释。
②配制溶液所用到的玻璃仪器除烧杯、玻璃棒外,还必须有__、__![]() 填仪器名称
填仪器名称![]() 。
。
③下列操作可能使所配溶液浓度偏小的是__![]() 填写序号
填写序号![]() 。
。
A.未洗涤烧杯和玻璃棒
B.定容时俯视容量瓶的刻度线
C.配溶液前容量瓶中有少量蒸馏水
D.摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以芳香族化合物A为主要原料,按下列线路合成抗癫痫药物W:

已知:![]()
请回答:
(1)下列说法正确的是________。
A.反应②是氧化反应 B.试剂X是浓硝酸和浓硫酸
C.反应③⑤的目的是保护![]() D.药物W的分子式是
D.药物W的分子式是![]()
(2)写出化合物C的结构简式________。
(3)写出反应⑥的化学方程式________。
(4)设计从G到H的合成路线(用流程图表示,无机试剂任选)________。
(5)写出化合物A的相邻同系物Y的同分异构体结构简式,且必须符合下列条件:________。
①能发生银镜反应;
②![]() 表明,分子中共有4种H原子;
表明,分子中共有4种H原子;
③除了苯环无其它环。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平以下方程式
K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2↑
以上反应中失电子的物质是_________,还原产物是______,每生成lmol这种还原产物,将有_________mol电子发生转移.氧化剂与还原剂的物质的量之比为_________.
(2)人体内的铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以补铁时,应补充含Fe2+的亚铁盐。服用维生素C可使食物中的Fe3+转化成Fe2+,利于人体对铁的吸收。
Ⅰ人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+![]() Fe3+。在过程A中,Fe2+作__________剂,过程B中,Fe3+作____________剂。
Fe3+。在过程A中,Fe2+作__________剂,过程B中,Fe3+作____________剂。
Ⅱ“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作_______剂,具有_____________性。
(3)已知反应:2H2S+H2SO3=2H2O+3S↓,若氧化产物比还原产物多1.6g,则冋时会生成水的质量为____g.
(4)除去Na2CO3粉末中混入的NaHCO3杂质用______方法,化学方程式为_______.
(5)向FeBr2溶液中通入足量Cl2(己知氧化性Cl2>Br2>Fe3+)化学方程式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列两个热化学方程式,回答下列问题:
2H2(g)+O2(g)![]() 2H2O(1) ΔH=571.6 kJ · mol1
2H2O(1) ΔH=571.6 kJ · mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
(1)H2的燃烧热为_______,C3H8的燃烧热为_______。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(3)现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com