
【题目】在不同温度下,水溶液中pH和pOH的关系如图所示,已知pH=-lgc(H+),pOH=-lgc(OH-)。下列说法一定正确的是( )

A.水的电离程度,B>A>D
B.lmolL-1Na2SO4溶液不可能处于B点
C.向C点水溶液中通入HCl,则C点变为E点
D.0.1molL-1NaHA溶液的pH和pOH的关系如图中E点所示,此时溶液中离子的物质的量浓度关系:c(HA-)>c(A2-)>c(H2A)
【答案】D
【解析】
如图: ,由Kw=c(H+)×c(OH-)得,Kw=10-pH×10-pOH,由此可知,曲线2的Kw大于曲线1的Kw,那么曲线2的温度高于曲线1的温度。
,由Kw=c(H+)×c(OH-)得,Kw=10-pH×10-pOH,由此可知,曲线2的Kw大于曲线1的Kw,那么曲线2的温度高于曲线1的温度。
A点:pH=pOH,则-lgc(H+)=-lgc(OH-),可得c(H+)=c(OH-),溶液显中性;同理,B点:pH=pOH,溶液显中性;C、D点:pH>pOH,-lgc(H+)>-lgc(OH-),可得c(H+)<c(OH-),溶液显碱性;E点:pH<pOH,溶液显酸性,据此解答。
A.B点的pH、pOH均小于A点,则B点的Kw大于A的点Kw,那么B点温度高于A点的温度,A、B、D点溶液若不涉及盐类水解,则水的电离程度:B>A>D,若涉及盐类水解,则无法判断,A错误;
B.Na2SO4溶液呈中性,由分析可知,B点显中性溶液,即lmolL-1Na2SO4溶液可能处于B点,B错误;
C.C点和E点所处温度不同,水的离子积Kw不同,所以通入HCl,则C点不能变为E点,C错误;
D.E点溶液显酸性,则NaHA溶液中,HA-的电离(HA-![]() H++A2-)程度大于水解(HA-+H2O
H++A2-)程度大于水解(HA-+H2O![]() H2A+OH-)程度,那么c(A2-)>c(H2A),电离和水解均很微弱,c(HA-)最大,故c(HA-)>c(A2-)>c(H2A),D正确。
H2A+OH-)程度,那么c(A2-)>c(H2A),电离和水解均很微弱,c(HA-)最大,故c(HA-)>c(A2-)>c(H2A),D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】化学与我们的生活密切相关,请回答:
(1)在生活中要注意饮食平衡,蛋白质属于_______(填序号,下同)食物,番茄属于______食物;①酸性 ②碱性
(2)有四种常见药物①阿司匹林、②青霉素、③胃舒平、④麻黄碱. 某同学胃酸过多,应该服用______(填序号,下同);从用药安全角度考虑,使用前要进行皮肤敏感性测试的是_____;由于具有兴奋作用,国际奥委会严禁运动员服用的是_________;
(3)苹果汁是人们喜爱的饮品,由于其中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有________(填序号);①氧化性 ②还原性 ③碱性 ④酸性
(4)食用植物油进入人体后,在酶的作用下水解为高级脂肪酸和_________(写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料;
(5)硫酸亚铁可用于治疗缺铁性贫血,某贫血患者每天须补充1.4g铁元素,则服用的药物中含硫酸亚铁的质量至少为_________g;
(6)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(﹣NH2)和____(写结构简式或名称).人体中共有二十多种氨基酸,其中人体自身________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸;
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水.写出葡萄糖在体内被氧化的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.54g H2O中含有3NA个氢原子
B.1mol Na2SO4溶于水中,所得溶液中Na+个数为NA
C.标准状况下,NA个H2O分子所占的体积约为22.4L
D.1mol CO2和NO2的混合物中含的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写中正确的是
A.氢氧化镁与盐酸反应:H++OH-=H2O
B.铁与盐酸反应:2Fe+6H+=2Fe3++3H2
C.氧化铝溶于稀硫酸:Al2O3+6H+=2Fe3++3H2O
D.向沸水中滴加FeCl3溶液制备Fe(OH)3 胶体:Fe3++3H2O=Fe(OH)3+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
I.(1)Y在元素周期表中的位置为________________。
(2)五种元素原子半径由大到小的顺序是(写元素符号)____________________。
(3)X、Z两元素能形成两种化合物的电子式分别为______________和________。
Ⅱ.生活中Q的氯化物是重要的调味品。随着对饮食健康的重视,出现了各种特种类型。
(1)常说“饮食过咸会伤骨”,下列物质中可以作为补钙药品主要成分的是__(填标号)。
A.CaCO3 B.CaO C.Ca(OH)2 D.Ca
(2)调味品中Q的含量降低,替而代之氯化钾和硫酸镁,可防治高血压和心血管病,往其溶液中滴入氨水,发生反应的离子方程式是________________________。
(3)调味品中也可加入硒元素,硒是人体微量元素中的“抗癌之王”,写出证明硒元素非金属性比硫元素弱的一个实验事实:__________________________。
(4)调味品中加入碘酸钾可防治碘缺乏症,其中的碘酸钾(KIO3)在酸性溶液中可氧化亚硫酸钠,生成物能使淀粉变蓝,1mol KIO3被还原时,转移电子________mol,写出主要生成物的化学式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。
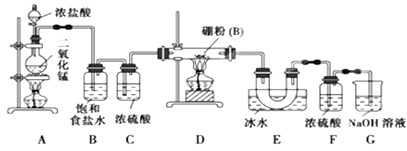
回答下列问题:
(1)写出装置A中发生反应的离子方程式________________。
(2)写出装置D中发生反应的化学方程式为_____________________。
(3)装置B、E的作用分别是________________、________________。
(4)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200mL Fe2(SO4)3溶液中含Fe3+56g,在该溶液中加入1mol/LBaCl2溶液300mL,反应后溶液中SO42-的物质的量浓度是(忽略混合后溶液的体积变化) ( )
A.7.5mol/LB.5mol/LC.6mol/LD.2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,下列关于X的说法不正确的是
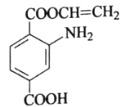
A.X分子中含有四种官能团
B.X能与金属钠反应,且相同条件下比水与金属钠反应要剧烈
C.1molX最多与5mol氢气发生加成反应
D.在一定条件下,X能发生加成、取代、加聚、缩聚、氧化、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯(![]() ,
,![]() )是一种重要的有机化工原料,可用环成二烯(
)是一种重要的有机化工原料,可用环成二烯(![]() ,
,![]() )制备。已知:
)制备。已知:
反应Ⅰ ![]()
![]()
反应Ⅱ ![]() (环戊烷)
(环戊烷) ![]()
反应Ⅲ ![]()
![]()
![]()
(1)某温度下,将环戊二烯和HI按物质的量之比1∶2(总物质的量为amol)充入容积为2L的恒容密闭容器中,发生反应:![]() 。
。
①该反应自发进行的条件是__________。
②下列有关该反应的叙述,不正确的是__________。
A.气体压强不变,说明反应达到平衡状态
B.升高温度,有利于提高环戊烯的产率
C.反应达到平衡时,C5H6和HI的转化率相等
D.通入惰性气体,有利于提高环戊二烯的平衡转化率
(2)以![]() 为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
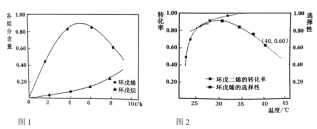
①环成二烯氢化制环成烯的最佳反应温度为__________,选择该温度的原因是__________。
②升高温度,环戊二烯转化率提高而环戊烯选择性降低,其原因是__________。
③在图1中画出40℃时环戊烯含量随t变化趋势的曲线。__________
(3)实际生产中,常由双环戊二烯通入水蒸气解聚成环戊二烯:

某温度,加入总压为70kPa的双环成二烯和水蒸气,达到平衡后总压为110kPa,双环戊二烯的转化率为80%,则该反应的平衡常数![]() __________(对于气相反应,用某组分B的平衡压强
__________(对于气相反应,用某组分B的平衡压强![]() 代替物质的量浓度
代替物质的量浓度![]() 也可表示平衡常数,记作
也可表示平衡常数,记作![]() )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com