
����Ŀ����ͼ����ѧ��ѧ�г����ڻ�����ķ�����ᴿװ�ã������װ�ûش����⣺
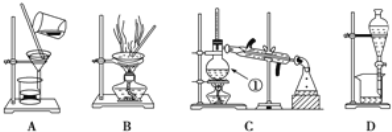
��1��װ��B�б�����������������________��װ��C�Тٵ�������________��
��2��ij�����ƹ����л����������������ʣ������һʵ�鷽�����ȳ�ȥ���ʣ��������������Һ��
ʵ�鷽�����Ƚ�������������ˮ�����Һ��ѡ����ʵ��Լ��Ͳ�����ɱ����и���ʵ�顣
ѡ���Լ� | �� | Na2CO3��Һ | �� |
ʵ����� | �� | �� | ���� |
��������Լ��ٿ�����________���ѧʽ����֤����Һ��SO42-�Ѿ������IJ�����____________������Na2CO3��Һ��Ŀ����_________________________����������Լ�����________���ѧʽ����
��3���������Ǹ�Ч�Ŀ�ű��ҩ��Ϊ��ɫ��״���壬���Ҵ��������п��ܽ⣬��ˮ�м������ܣ��۵�Ϊ156-157�������ȶ��Բ��֪�����ѷе�Ϊ35������ȡ�����ص���Ҫ����Ϊ��
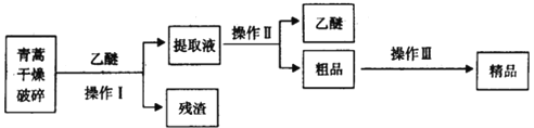
��Ҫ��ʵ����ģ���������գ�����Iѡ���ʵ��װ����____������ţ���������ѡ���ʵ��װ����______������ţ�������������Ҫ�����������________������ĸ����
A.��ˮ�ܽ⣬����Ũ������ȴ�ᾧ������
B.��95%���Ҵ���Ũ�����ᾧ������
C.�������ѽ�����ȡ��Һ
���𰸡������� ������ƿ Ba(NO3)2����Ba(OH)2 ���ã����ϲ���Һ�м����μ�Ba(NO3)2����Ba(OH)2���������������ѳ��� ��ȥ������Ba2+ HNO3 A C B
��������
��1�����������Ĺ����֪��װ��B�б�����������������������װ��C�Тٵ�������������ƿ��
��2���Լ���ΪBa(NO3)2����Ba(OH)2��ʹ���������ת��Ϊ���ᱵ������ͬʱ���������ƣ�
���ã����ϲ���Һ�м����μ�Ba(NO3)2����Ba(OH)2��������������֤����Һ��SO42-�Ѿ�������Ϊ��ȥ������Ba2+������Na2CO3��Һ����������Լ�����HNO3���Գ�ȥ����������������̼���ƣ�
��3������IΪ���ˣ�ѡ��װ��A����ȡҺ��������õ����Ѻʹ�Ʒ��������Ϊ����ѡ��װ��C��Ϊ��ֹ���У���Ҫ�������Ƭ��������Ӵ�Ʒ�о����ܽ⡢Ũ���ᾧ���ٽ��й��˵õ���Ʒ����ѡ B��


 ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�Ǻ˵����������������ֶ���������Ԫ�أ�AԪ�ص�ԭ�Ӻ���ֻ��1�����ӣ�BԪ�ص�ԭ�Ӱ뾶����������������С�ģ�B������������Ӧˮ����Ļ�ѧʽΪHBO3��CԪ��ԭ�ӵ������������ȴ����ࣴ����C����������D�������Ӿ�����ͬ�ĵ����Ų�����Ԫ�ؿ��γɻ�����D2C��C��Eͬ���塣
��1��C�����ڱ��е�λ��____________________��
��2����A��B��C����Ԫ���γɵ����ӻ�����Ļ�ѧʽΪ______________________��
��3��Ԫ��C��D��E�γɵ����Ӱ뾶��С��ϵ��___________________�������ӷ��ű�ʾ��.
��4���õ���ʽ��ʾ������D2C���γɹ���____________________________________��
C��D�����γɻ�����D2C2��D2C2���еĻ�ѧ����_____________________________������Ҫ��;��______________________��
��5�����п����м���Ƭ�����ɵ�D��������ٶ�ȫΪD2C2��D2C�Ļ���a�ˣ���VLHCl��Ӧ�����ԣ���HCl��Ũ��ȡֵ��ΧΪ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ�ֳ��̱�ʯ������Ҫ�ɷ�ΪBenAl2[Si6O18]��Ҳ�����ö�������ͽ������������ʽ��ʾ����nΪ
A.1B.2C.3D.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ������������ȼ������Al2O3����˿��������ȼ��Ҳ����Fe2O3
B. ���ܴ�����ͭ��Һ���û���ͭ����Ҳ�ܴ�����ͭ��Һ�п����û���ͭ
C. ��Ƭ�������γ����ܵ�����Ĥ���ƿ����Ҳ���γ����ܵ�����Ĥ
D. ����������ˮ�ȷ�Ӧʱ�ƾ�����ԭ�����������ʲ���������ԭ��Ӧʱ����������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱŨ�ȶ���1 mol/L������������Һ��AX��BX��AY��BY��AX��Һ��pH��7����Һ��c(X��)��1 mol/L��BX��Һ��pH��4��BY��Һ��pH��6������˵����ȷ����(����)
A. ����ƽ�ⳣ����K(BOH)<K(HY)
B. AY��Һ��pHС��BY��Һ��pH
C. ϡ����ͬ��������ҺpH�仯��BX����BY
D. ��pH��Ϊ1��HX��HY��Һ�ֱ�ϡ��10����HX��Һ��pHС��HY��Һ��pH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڶ������У��ס��ҡ���������������Ԫ�ص�λ����ͼ����ԭ�Ӱ뾶����Ԫ���ǣ� ��
�� | �� |
�� | �� |
A.��B.��C.��D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����е������仯����ͼһ�µ���
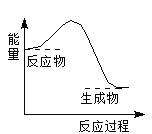
A. 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
B. C+CO2![]() 2CO
2CO
C. CaCO3![]() CaO+CO2��
CaO+CO2��
D. C+H2O![]() CO+H2
CO+H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ������£�ijˮ��ҺM�д��ڵ�������Na����A2����HA����H����OH�������ڵķ�����H2O��H2A����������ش��������⣺
(1)д����H2A�ĵ��뷽��ʽ_________________________��
(2)����ҺM��10 mL 2 mol��L��1NaHA��Һ��10 mL 2 mol��L��1 NaOH��Һ�������϶��ɣ�����ҺM��pH________(����<����>����������)7����Һ������Ũ���ɴ�С��˳��Ϊ______________����֪Ksp(BaA)��1.8��10��10�������Һ�м���10 mL 1 mol��L��1BaCl2��Һ����Ϻ���Һ�е�Ba2��Ũ��Ϊ________mol��L��1��
(3)��������������Һ����0.01 mol��L��1��H2A��Һ����0.01 mol��L��1��NaHA��Һ����0.02 mol��L��1��HCl��0.04 mol��L��1��NaHA��Һ�������ϣ�����������£���Һ��c(H2A)������____________��pH�ɴ�С��˳��Ϊ______________��
(4)����ҺM��pH��3��H2A��ҺV1 mL��pH��11��NaOH��ҺV2 mL��Ϸ�Ӧ���ã������Һ��![]() ��104��V1��V2�Ĵ�С��ϵΪ________(����V1����V2����V1����V2����V1С��V2���������п�����)��
��104��V1��V2�Ĵ�С��ϵΪ________(����V1����V2����V1����V2����V1С��V2���������п�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ����Ļ����Һ200 mL��ƽ���ֳ����ݡ�������һ�������� ͭ�ۣ��������19.2 g(��֪����ֻ����ԭΪNO����)������һ���������� �ۣ�������������������������ӵı仯����ͼ��ʾ�����з�����������ȷ����(����)

A. ͼ�У�AB�εķ�ӦΪFe��2Fe3��===3Fe2������Һ����������Ϊ��������
B. ԭ��Һ������Ũ��Ϊ2.5 mol��L��1
C. ԭ�����Һ����������ӵ����ʵ���Ϊ0.4 mol
D. ͼ�У�OA�β�����������һ��������BC�β���������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com