
����Ŀ��25 ��ʱŨ�ȶ���1 mol/L������������Һ��AX��BX��AY��BY��AX��Һ��pH��7����Һ��c(X��)��1 mol/L��BX��Һ��pH��4��BY��Һ��pH��6������˵����ȷ����(����)
A. ����ƽ�ⳣ����K(BOH)<K(HY)
B. AY��Һ��pHС��BY��Һ��pH
C. ϡ����ͬ��������ҺpH�仯��BX����BY
D. ��pH��Ϊ1��HX��HY��Һ�ֱ�ϡ��10����HX��Һ��pHС��HY��Һ��pH
���𰸡�A
��������
���⿼������ˮ���֪ʶ��25 ��ʱŨ�ȶ���1 mol/L������������Һ:AX��BX��AY��BY,AX����ҺpH��7����Һ��c(X��)��1 mol/L,��AX��ǿ��ǿ����,����AOH��ǿ�HX��ǿ����BX����ҺpH��4,HX��ǿ��,��BX��ǿ��������,BOH������;��ͬŨ��ʱ, ��ΪBY��Һ��pH��6��BY������������ ,��B+ˮ��̶ȴ���Y-�� A.������ʵĵ���ƽ�ⳣ��Խ��,������ˮ��̶�ԽС��B.AY������ǿ���Ρ�BY��������������C.ͬһ��IJ�ͬ�������Һ,����Խǿ,ϡ����ͬ����,��Һ��pH�仯Խ����D.ϡ����ͬŨ�ȵIJ�ͬһԪ����Һ,ǿ���pH����������
A.����������������Ƴ�BY������������,��![]() ˮ��̶ȴ���
ˮ��̶ȴ���![]() ,������ˮ��̶�Խ������Ӧ������ʵ���̶�ԽС,����BOH�ĵ���̶�С��HY,����̶�Խ��,�����ƽ�ⳣ��Խ��,���Ե���ƽ�ⳣ��
,������ˮ��̶�Խ������Ӧ������ʵ���̶�ԽС,����BOH�ĵ���̶�С��HY,����̶�Խ��,�����ƽ�ⳣ��Խ��,���Ե���ƽ�ⳣ��![]() С��
С��![]() ,��Aѡ������ȷ����B�ɷ���֪.AY������ǿ������AY��Һ�ʼ�����BY��������������BY��Һ������,����AY��Һ��pH����BY,��B������C.ͬһ��IJ�ͬ�������Һ,����Խǿ,ϡ����ͬ����,��Һ��pH�仯Խ��,HX��ǿ�ᡢHY������,ϡ����ͬ����,��ҺpHֵ�仯BX����BY,��C������D.ϡ����ͬŨ�ȵIJ�ͬһԪ����Һ,ǿ���pHС������,HX��ǿ�ᡢHY������,���Խ�Ũ�Ⱦ�Ϊ
,��Aѡ������ȷ����B�ɷ���֪.AY������ǿ������AY��Һ�ʼ�����BY��������������BY��Һ������,����AY��Һ��pH����BY,��B������C.ͬһ��IJ�ͬ�������Һ,����Խǿ,ϡ����ͬ����,��Һ��pH�仯Խ��,HX��ǿ�ᡢHY������,ϡ����ͬ����,��ҺpHֵ�仯BX����BY,��C������D.ϡ����ͬŨ�ȵIJ�ͬһԪ����Һ,ǿ���pHС������,HX��ǿ�ᡢHY������,���Խ�Ũ�Ⱦ�Ϊ![]() ��HX��HY��Һ�ֱ�ϡ��10����,HX��Һ��pHС��HY,��D����������Aѡ������ȷ����
��HX��HY��Һ�ֱ�ϡ��10����,HX��Һ��pHС��HY,��D����������Aѡ������ȷ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ���з���һ�������¡��ɺ�������Na��CO2���ε�ء���NaClO4�����л��ܼ���Ϊ���Һ���ƺ���̼���ܵ������ֱ���Ϊ�缫���ϣ���ص��ܷ�ӦΪ��3CO2+4Na![]() 2Na2CO3+C������˵���������
2Na2CO3+C������˵���������

A. �ŵ�ʱ��ClO4�����ƶ�
B. ���ʱ�ͷ�CO2���ŵ�ʱ����CO2
C. �ŵ�ʱ��������ӦΪ��3CO2+4e ��2CO32��+C
D. ���ʱ��������ӦΪ��Na++e��Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S2O3��һ�����ᣬʵ��������0.01 mol/L��Na2S2O3��Һ�ζ���ˮ�������ķ�ӦΪI2��2Na2S2O3===2NaI��Na2S4O6������˵����ȷ����(����)
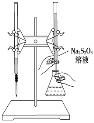
A. �õζ���Ӧ���ü�����ָʾ��
B. Na2S2O3�Ǹ÷�Ӧ�Ļ�ԭ��
C. �õζ���Ӧ��ѡ������ͼ��ʾ��װ��
D. �÷�Ӧ��ÿ����2 mol Na2S2O3��ת�Ƶ��ӵ����ʵ���Ϊ4 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ����
A. �����£�9.2gNO2��N2O4�Ļ�������к��еĵ�ԭ����ĿΪ0.2NA
B. 22.4L N2��CO��ɵĻ�����������еĵ�����Ϊ14NA
C. 0.1mol/L K2CO3��Һ������K����ĿΪ0.2NA
D. �ڷ�ӦKClO3+6HCl=KCl+3Cl2��+3H2O�У�ÿ����3molCl2ת�Ƶĵ�����Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0��100 0 mol��L��1������ζ�20��00 mLδ֪Ũ�ȵİ�ˮ���ζ�������ͼ��ʾ���μ�20��00 mL����ʱ������Һ��c(Cl��)��c(NH4+)+c(NH3��H2O)+c(NH3)������˵���������

A. �ð�ˮ��Ũ��Ϊ0��100 0 mol��L��1
B. �����Һ��c(NH4+)+c(NH3��H2O)+c(NH3)��2c(Cl��)
C. �����Һ��c(NH4+)��c(Cl��)
D. �����Һ��c(Cl��)>c(H+)>c(NH4+)>c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ�����ķ�����ᴿװ�ã������װ�ûش����⣺
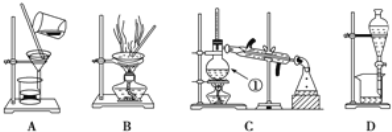
��1��װ��B�б�����������������________��װ��C�Тٵ�������________��
��2��ij�����ƹ����л����������������ʣ������һʵ�鷽�����ȳ�ȥ���ʣ��������������Һ��
ʵ�鷽�����Ƚ�������������ˮ�����Һ��ѡ����ʵ��Լ��Ͳ�����ɱ����и���ʵ�顣
ѡ���Լ� | �� | Na2CO3��Һ | �� |
ʵ����� | �� | �� | ���� |
��������Լ��ٿ�����________���ѧʽ����֤����Һ��SO42-�Ѿ������IJ�����____________������Na2CO3��Һ��Ŀ����_________________________����������Լ�����________���ѧʽ����
��3���������Ǹ�Ч�Ŀ�ű��ҩ��Ϊ��ɫ��״���壬���Ҵ��������п��ܽ⣬��ˮ�м������ܣ��۵�Ϊ156-157�������ȶ��Բ��֪�����ѷе�Ϊ35������ȡ�����ص���Ҫ����Ϊ��
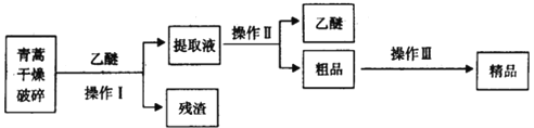
��Ҫ��ʵ����ģ���������գ�����Iѡ���ʵ��װ����____������ţ���������ѡ���ʵ��װ����______������ţ�������������Ҫ�����������________������ĸ����
A.��ˮ�ܽ⣬����Ũ������ȴ�ᾧ������
B.��95%���Ҵ���Ũ�����ᾧ������
C.�������ѽ�����ȡ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A~HΪ��ѧ��ѧ�еij������ʣ�����֮���ת����ϵ����ͼ��ʾ��������������������������������ʡ�AΪ����θ������һ��ҩ����GΪ����ɫ���壬C��ͨ��״����Ϊ��ɫҺ�塣

��ش��������⣺
��1��G�Ļ�ѧʽΪ_____________����Ӧ���У�ÿ����1 mol H��ת��________mol���ӡ�
��2����Ӧ��~���У����ڷ�������ԭ��Ӧ����________(�����)��
��3��д�����з�Ӧ�����ӷ�Ӧ����ʽ����ҺA��H��ϣ�_______________________________����D��ϡ��Һ��ͨ��B�� ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ݱ������ṩ�ļס��ҡ�����������Ԫ�ص������Ϣ����������⣺
Ԫ�� | �� | �� | �� | �� |
ԭ������ | 11 | �� | ||
Ԫ�ط��� | �� | S | ||
ԭ�ӽṹʾ��ͼ | �� |
| ||
Ԫ�����ڱ��е�λ�� | �������ڵڢ�A�� | �� |
��1����д�����и��������Ӧ�Ŀհף���_________________��__________________
��_________________��_________________��
��2���ס��ҡ�����������Ԫ���У�ԭ�Ӱ뾶������____________����Ԫ�ط��ţ�����Ԫ�ص��������Ϊ______________�ۡ�
��3��Ԫ�ص�����������Ӧˮ�����м�����ǿ����_________���ѧʽ����ͬ���� �����Ե�����������__________________��������ǿ����__________________��
��4������������Ӧˮ����ļ��ԣ���_______________�ң������������������̬�⻯����ȶ��ԣ���_______________�����������������
��5��Ԫ���ҵ�����������Ӧˮ���������Ԫ�ؼ�����������Ӧˮ���ﷴӦ�������к����θ�ᡣ��д���к�θ������ӷ���ʽ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaN3����������ȫ��������������巢����ԭ�ϡ���ҵˮ���·��Ʊ��������ƵĹ���������ͼ��ʾ��

��֪��NaN3����AgNO3��Ӧ���ɰ�ɫ������ˮ��AgN3������������ʵ������������±���
�۵�� | �е�� | �ܽ��� | |
CH3OH | 97 | 64.7 | ��ˮ���� |
ˮ���� (N2H4H2O) | 51.7 | 118.5 | ��ˮ�������ܣ����������Ѻ��ȷ� |
���������(CH3ONO) | 17 | 12 | �����Ҵ������� |
��ش�
��1���������NaNO2��ϡ���ᷢ������Ӧ�����������壨����һ�������ڿ����п���ת��Ϊ�����е���һ�����壩�����ӷ���ʽΪ_________________________�������������NaN3�Ļ�ѧ����ʽΪ______________________��
��2��ʵ����ģ�ⲽ���ʵ��װ����ͼ��װ������ȴˮʡ�ԣ���ͬ����

������a������Ϊ____________��������_________________��
�ڸ���ʵ�鷢���¶���20�����ҷ�Ӧ��ѡ���Ժ�ת������ߣ����Ǹ÷�Ӧ���ڷ��ȷ�Ӧ����˿��Բ�ȡ�Ĵ�ʩ��____________�����������֣�
��ͼ��X�����ӵ������װ��ӦΪ��ͼ�е�_________��

��3����������Ʊ��������ƵIJ�����_______�����������ҺA��������ĺ�������˳����___________��(�����)�ٴ�K1��K2���ر�K3 �ڴ�K3 �ۼ��� �ܹر�K1��K2
��4�����������ҺB������������Һ�����1/3��NaN3�ᾧ������
�ٲ����������_______ϴ�Ӿ��塣
A��ˮ B������ C���Ҵ�ˮ��Һ D���Ҵ�
�ڳ����ζ����ⶨ��Ʒ���ȣ����Ե���ɫK2CrO4��Һ��ָʾ������AgNO3����Һ������Ʒ��Һ��������Ag2CrO4���֣��������ٺ�ɫ���������ﵽ�ζ��յ㡣AgNO3��ҺҪװ����ɫ����ʽ�ζ�������еζ���������__________�����в�����������______��
A���ζ��ܹܼⲻ�ɽӴ���ƿ�ڱ�
B���ζ�ʱ��Һ�ٶ�Ӧ�ȿ�������ӽ��յ�ʱһ��һҡ
C���ζ������п�������ˮ����ƿ����ճ������Һ����
D����δ�ȵζ���Һ���ȶ��Ͷ������ᵼ�²ⶨ���ƫ��
E��������AgNO3��Һ�μӹ������ɻص���Ʒ��Һ������ɫ��ȥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com