
【题目】常温下,用0.100 0 mol·L-1的盐酸滴定20.00 mL未知浓度的氨水,滴定曲线如图所示,滴加20.00 mL盐酸时所得溶液中c(Cl-)=c(NH4+)+c(NH3·H2O)+c(NH3)。下列说法错误的是

A. 该氨水的浓度为0.100 0 mol·L-1
B. 点①溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=2c(Cl-)
C. 点②溶液中c(NH4+)=c(Cl-)
D. 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-)
【答案】D
【解析】
本题主要考查酸碱中和相关曲线分析。
A.由题可知,当滴加20mL盐酸时,溶液中溶质为NH4Cl,由此可求出氨水的浓度;
B.点①溶液中溶质为等浓度NH4Cl和NH3H2O的混合溶液,依据物料守恒判断;
C.点②依据电荷守恒判断;
D.点③时氨水和氯化氢恰好完全反应,反应后溶质为氯化铵。
A.由图象曲线变化可知,加入20mL盐酸时出现滴定飞跃,说明氨水与盐酸的浓度相等,所以该氨水的物质的量浓度为0.1000mol/L,故A正确;
B.点①时滴入10mL盐酸,由于盐酸与氨水浓度相等,反应后溶质为等浓度的NH4Cl和NH3H2O,根据物料守恒可知:c(NH4+)+c(NH3H2O)+c(NH3)=2c(Cl-),故B正确;
C.点②时溶液为中性,则c(H+)=c(OH-),根据溶液中的电荷守恒可知:c(NH4+)=c(Cl-),故C正确;
D.点③时NH3H2O和HCl恰好完全反应,反应后溶质为NH4Cl,铵根离子部分水解,溶液呈酸性,由于水解程度较小,则c(Cl-)>c(NH4+)、c(H+)>c(OH-),由于水解程度较小,则c(NH4+)>c(H+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),错误。


科目:高中化学 来源: 题型:
【题目】已知碳碳单键可绕键轴自由旋转,某烃的结构简式如下图所示,下列说法中正确的是
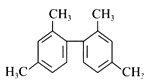
A. 该物质所有原子均可共面
B. 分子中至少有10个碳原子处于同一平面上
C. 分子中至少有11个碳原子处于同一平面上
D. 该烃与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型无机材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等称为非氧化物陶瓷,合成这些物质需在高温条件下进行,在合成工艺中必须注意( )
A.通入充足的氧气B.避免与氧气接触
C.可在氮气气氛中合成D.通入少量氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O![]() NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
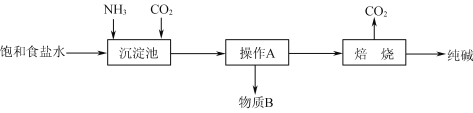
请回答下列问题:
①析出的NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是_______________________________________________________________________。
②向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,其原因是_______________________________________________________________________。
③该工艺流程中可回收再利用的物质是________________。
④若制得的纯碱中只含有杂质NaCl。测定该纯碱的纯度,下列方案中可行的是________(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
(2)常温下在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液20 mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如下图所示。
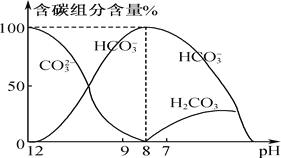
根据图示回答下列问题:
①在同一溶液中,CO32-、HCO3-、H2CO3________(填“能”或“不能”)大量共存。
②在滴加盐酸的过程中HCO3-的物质的量先增加后减少的原因是_____________、________(请分别用离子方程式表示)。
③将0.84 g NaHCO3和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.10 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是___________(填字母)。
A. 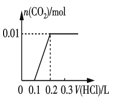 B.
B. 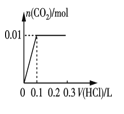
C. 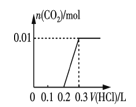 D.
D. 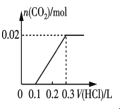
(3)若称取10.5 g纯净的NaHCO3固体,加热一段时间后,剩余固体的质量为8.02 g。如果把剩余的固体全部加入到100 mL 2 mol·L-1的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度(设溶液的体积变化及盐酸的挥发忽略不计)(写出计算过程)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是

A. 上述提取Mg的流程中,没有涉及的反应类型是置换反应
B. 因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C. 反应⑥所用的气态氧化剂可从本厂生产烧碱处循环利用或从本厂生产镁单质处循环利用
D. 从母液中提取Mg和Br2的先后顺序:先提取Br2,后提取Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时浓度都是1 mol/L的四种正盐溶液:AX、BX、AY、BY。AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是( )
A. 电离平衡常数:K(BOH)<K(HY)
B. AY溶液的pH小于BY溶液的pH
C. 稀释相同倍数,溶液pH变化:BX等于BY
D. 将pH均为1的HX和HY溶液分别稀释10倍后,HX溶液的pH小于HY溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
(1)基态硼原子的价电子轨道表达式是_______________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________。
(2)晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的________。
(3)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______,写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。BH![]() 的键角是________,立体构型为___________。
的键角是________,立体构型为___________。
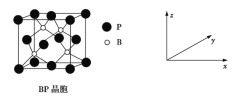
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______;已知晶胞边长为458 pm,则磷化硼晶体的密度是____g·cm-3(列式并计算,结果保留两位有效数字,已知4.583=96.07)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中发生的可逆反应:X(g)+3Y(g) ![]() 2Z(g),下列说法能充分说明该反应已经达到平衡状态的是( )
2Z(g),下列说法能充分说明该反应已经达到平衡状态的是( )
A. X、Y、Z的浓度均不再发生变化B. X、Y、Z在容器中共存
C. v(正) = v(逆) = 0D. 单位时间内消耗a mol X同时生成2a mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]() >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不![]() 变
变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com