
����Ŀ��������һ�ַdz���Ҫ�Ļ���ԭ�ϣ��ڲ��������ϡ��ϳ�ϴ�Ӽ��ȹ�ҵ�����Ź㷺��Ӧ�á�
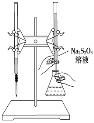
��1����ҵ���������Ƽ����NaCl��NH3��CO2��ˮ��Ϊԭ���Ʊ�����䷴Ӧԭ��Ϊ��NaCl��NH3��CO2��H2O![]() NaHCO3����NH4Cl����������Ĺ�������ʾ��ͼ���£�
NaHCO3����NH4Cl����������Ĺ�������ʾ��ͼ���£�
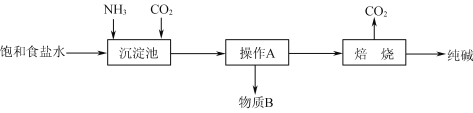
��ش��������⣺
��������NaHCO3�����п��ܺ����������������ʣ�����þ������Ƿ������������ʵIJ���������_______________________________________________________________________��
�������������ͨ������NH3����ͨ��CO2������NaHCO3���������Na2CO3���壬��ԭ����_______________________________________________________________________��
�۸ù��������пɻ��������õ�������________________��
�����ƵõĴ�����ֻ��������NaCl���ⶨ�ô���Ĵ��ȣ����з�������������________(����ĸ)��
a. ��m�˴�����Ʒ�м�������CaCl2��Һ�����������ˡ�ϴ�ӡ������������Ϊb g
b. ��m�˴�����Ʒ�м�������ϡ���ᣬ�ü�ʯ��(��Ҫ�ɷ���CaO��NaOH)���ղ��������壬��ʯ������b g
c. ��m�˴�����Ʒ�м�������AgNO3��Һ�������ij��������ˡ�ϴ�ӡ������������Ϊb g
��2����������10 mL 0.1 mol��L��1 Na2CO3��Һ����μ���0.1 mol��L��1 HCl��Һ20 mL����Һ�к�̼Ԫ�صĸ���������������(����)����ҺpH�仯�IJ����������ͼ��ʾ��
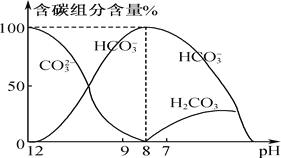
����ͼʾ�ش��������⣺
����ͬһ��Һ�У�CO32����HCO3����H2CO3________(��ܡ����ܡ�)�������档
���ڵμ�����Ĺ�����HCO3�������ʵ��������Ӻ���ٵ�ԭ����_____________��________(��ֱ������ӷ���ʽ��ʾ)��
�۽�0.84 g NaHCO3��1.06 g Na2CO3��ϲ������Һ������Һ�еμ�0.10 mol��L-1ϡ���ᡣ����ͼ������ȷ��ʾ������������������CO2�����ʵ����Ĺ�ϵ����___________������ĸ����
A. 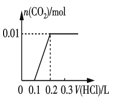 B.
B. 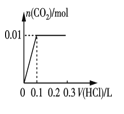
C. 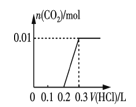 D.
D. 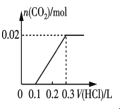
��3������ȡ10.5 g������NaHCO3���壬����һ��ʱ���ʣ����������Ϊ8.02 g�������ʣ��Ĺ���ȫ�����뵽100 mL 2 mol��L��1�������г�ַ�Ӧ������Һ��ʣ�����������ʵ���Ũ�ȣ�����Һ������仯������Ļӷ����Բ��ƣ���д��������̣���___________
���𰸡�ȡ������������ˮ��������������Һ������ϡ���ᣬ��������ɫ����������Cl������֮��û�� NH3��CO2��H2O�ȷ�Ӧ����NH4HCO3��NH4HCO3��NaCl��Ӧ����NaHCO3 ��NaHCO3���ܽ������ͬ������С��Na2CO3 ������NaHCO3������ CO2 ac ���� CO32���� H+ === HCO3�� HCO3���� H+ === H2O��CO2�� D 0.75 mol��L��1
��������
��1���ټ��龧�����Ƿ��������ӣ�ȡ������������ˮ����ϡHNO3�ữ���ٵμ�AgNO3��Һ����������ɫ�������þ����к��������ӣ��ʴ�Ϊ��ȡ������������ˮ��������������Һ������ϡ���ᣬ��������ɫ����������Cl������֮��û�У�
������ͬ�¶��£�̼���Ƶ��ܽ�ȴ���̼�����ƣ��������������ͨ������NH3����ͨ��CO2������NaHCO3���������Na2CO3���壬�ʴ�Ϊ��NH3��CO2��H2O�ȷ�Ӧ����NH4HCO3��NH4HCO3��NaCl��Ӧ����NaHCO3 ��NaHCO3���ܽ������ͬ������С��Na2CO3 ������NaHCO3��������
����ͼ��֪���������п�ѭ�����õ�������CO2��
��a.��m�˴�����Ʒ�м�������CaCl2��Һ��Na2CO3��CaCl2��Ӧ����CaCO3���������������ˡ�ϴ�ӡ������������Ϊb g���ɼ��������Ĵ���=![]() =
=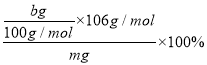 ����ȷ��
����ȷ��
b.��m�˴�����Ʒ�м�������ϡ���ᣬNa2CO3��NaHCO3�������ϡ���ᷴӦ���ܲ���CO2���壬�ü�ʯ��(��Ҫ�ɷ���CaO��NaOH)���ղ��������壬��ʯ������b g����ȷ��NaHCO3��Na2CO3�������������㴿��ȣ�����
c.��m�˴�����Ʒ�м�������AgNO3��Һ��Na2CO3��AgNO3��Ӧ����Ag2CO3�����������ij��������ˡ�ϴ�ӡ������������Ϊb g���ɼ��������Ĵ���=![]() =
=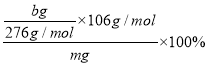 ����ȷ��
����ȷ��
��ѡac��
��2���٣�H2CO3�ᷢ�������H+�� HCO3���ᷢ�������H+�ͷ���ˮ����H+�� CO32���ᷢ��ˮ����H+��ϣ���H2CO3��HCO3����CO32�����ܴ������棻
���ڵμ�����Ĺ�����HCO3�������ʵ��������Ӻ���ٵ�ԭ����CO32���� H+ = HCO3����HCO3���� H+ = H2O��CO2����
��0.84gNaHCO3�����ʵ���Ϊ0.01mol��1.06g Na2CO3�����ʵ���Ϊ0.01mol������Ϻ���Һ�к���0.01molHCO3-��0.01molCO32-���μ����ᣬCO32-����H+��Ӧ��CO32-+H+=HCO3-�����ų����壬����0.01molH+��0.1L�����ʱ��Һ�к���0.02molHCO3-�������μ����ᣬHCO3-��H+��Ӧ������Ӧ��HCO3-+H+=H2O+CO2���������������0.02molHCO3-��ȫ��Ӧ��������0.2L�����μ�������0.3Lʱ����CO2�ﵽ���ֵ����ѡD��
��3��n(NaHCO3) =![]() =0.125 mol, NaHCO3������ȫת���NaCl,������������ʵ�������NaHCO3���ʵ�������n (HCl)ʣ��=n (HCl) -n (NaHCO3) =0.1L��2mol/L-0.125mol=0.07 5mol����c (HCl)ʣ��=
=0.125 mol, NaHCO3������ȫת���NaCl,������������ʵ�������NaHCO3���ʵ�������n (HCl)ʣ��=n (HCl) -n (NaHCO3) =0.1L��2mol/L-0.125mol=0.07 5mol����c (HCl)ʣ��=![]() =0.75 mol/L��
=0.75 mol/L��
��:��Һ��ʣ�����������ʵ���Ũ��Ϊ0.75 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�Ļ�ѧ��Ӧ����ʽ�����ж��䷴Ӧ���ͣ��ӳɡ�ȡ����������
�ټ�����������Ӧ_______________________________������________��Ӧ
����ϩͨ����ˮ��_________________________________������________��Ӧ
���Ҵ�������Ʒ�Ӧ��__________________________________������________��Ӧ
���ɱ���ȡ��������_______________________________������________��Ӧ��
�����ȵ�ͭ˿��η����ز����Ҵ��У�___________________������_______��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��5���л���ѧ����]�л�������F��һ����Ҫ���л��ϳ��м��壬��ϳ�·������ͼ��ʾ��

��֪����A�ĺ˴Ź�������ͼ����ʾ������F�Ľṹ��ʽΪ��

��ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���
��![]()
��ش��������⣺
(1)A������Ϊ______________(ϵͳ������)��Z�����������ŵ�������___________��
(2)��Ӧ��ķ�Ӧ������__________����Ӧ��ķ�Ӧ����Ϊ__________ ��
(3)E�Ľṹ��ʽΪ_______________________��
(4)д����Ӧ���Ļ�ѧ����ʽ____________________________________________��
(5)д����ӦIV���Ļ�ѧ����ʽ____________________________________________��
(6)W��Z��ͬϵ���Է���������Z��14����W��ͬ���칹������������������
���ܷ���������Ӧ���ڱ�����������ȡ�������۲���ˮ�⣬��FeCl3��Һ����ɫ�Ľṹ����_________��(�����������칹)���˴Ź��������������ĽṹΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S2O3��һ�����ᣬʵ��������0.01 mol/L��Na2S2O3��Һ�ζ���ˮ�������ķ�ӦΪI2��2Na2S2O3===2NaI��Na2S4O6������˵����ȷ����(����)
A. �õζ���Ӧ���ü�����ָʾ��
B. Na2S2O3�Ǹ÷�Ӧ�Ļ�ԭ��
C. �õζ���Ӧ��ѡ������ͼ��ʾ��װ��
D. �÷�Ӧ��ÿ����2 mol Na2S2O3��ת�Ƶ��ӵ����ʵ���Ϊ4 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������и��������У�
A O2��O3 B 뮺�� C CH4��CH3��CH2��2CH3
D ![]() ��
��![]() E CH3��CH2��2 CH3��
E CH3��CH2��2 CH3��![]()
�ٻ�Ϊͬλ�ص���__________ �ڻ�Ϊͬ�����������______��
�ۻ�Ϊͬϵ�����__________ �ܻ�Ϊͬ���칹����_____��������ѡ��ţ�
��2�����и������ʣ���H2O��NH3��KOH��Na2O2 ��MgCl2��Ne �������ڻ�ѧ������_____��ֻ�������Ӽ�����_____�����ڹ��ۻ��������_______�����Ǽ��Լ������ӻ�������__________________��
��3��CO2�ĵ���ʽΪ ________________��NH3�ĽṹʽΪ _______________��
��4��Na2O2�ۻ�ʱ���ƻ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ����
A. �����£�9.2gNO2��N2O4�Ļ�������к��еĵ�ԭ����ĿΪ0.2NA
B. 22.4L N2��CO��ɵĻ�����������еĵ�����Ϊ14NA
C. 0.1mol/L K2CO3��Һ������K����ĿΪ0.2NA
D. �ڷ�ӦKClO3+6HCl=KCl+3Cl2��+3H2O�У�ÿ����3molCl2ת�Ƶĵ�����Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0��100 0 mol��L��1������ζ�20��00 mLδ֪Ũ�ȵİ�ˮ���ζ�������ͼ��ʾ���μ�20��00 mL����ʱ������Һ��c(Cl��)��c(NH4+)+c(NH3��H2O)+c(NH3)������˵���������

A. �ð�ˮ��Ũ��Ϊ0��100 0 mol��L��1
B. �����Һ��c(NH4+)+c(NH3��H2O)+c(NH3)��2c(Cl��)
C. �����Һ��c(NH4+)��c(Cl��)
D. �����Һ��c(Cl��)>c(H+)>c(NH4+)>c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A~HΪ��ѧ��ѧ�еij������ʣ�����֮���ת����ϵ����ͼ��ʾ��������������������������������ʡ�AΪ����θ������һ��ҩ����GΪ����ɫ���壬C��ͨ��״����Ϊ��ɫҺ�塣

��ش��������⣺
��1��G�Ļ�ѧʽΪ_____________����Ӧ���У�ÿ����1 mol H��ת��________mol���ӡ�
��2����Ӧ��~���У����ڷ�������ԭ��Ӧ����________(�����)��
��3��д�����з�Ӧ�����ӷ�Ӧ����ʽ����ҺA��H��ϣ�_______________________________����D��ϡ��Һ��ͨ��B�� ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��ǽ���Ԫ�ؼ��仯��������ʾ�����Ҫ���塣
��. ��������ȼ�ջ����������������Ҫ�ɷ���SO2��CO2��N2��O2��ij�о���ѧϰС����ʵ��������װ�òⶨ������SO2�����������

��1����������������ͨ��C��Dװ�ã�����C��D��ʢ�е�ҩƷ�ֱ���_______��________��������ţ�
��KMnO4��Һ �ڱ���NaHSO3��Һ �۱���Na2CO3��Һ�ܱ���NaHCO3��Һ
��2��������������ΪamL/min����t1���Ӻ����Ͳ��Һ�����ΪVmL����SO2���������___________��

II.ij��ѧ��ȤС��Ϊ̽��Cl2��Br2��Fe3����������ǿ�����������ʵ�飺
��3�����װ��A�������ԣ�_________________�����Һ©����עˮ����ˮ����˳�����£������������á�
��4������ʵ��װ�ô���һ�����ԵIJ��㣬��ָ����___________________________��
��5���ø������װ�ý���ʵ�飬ʵ��������£�
ʵ����� | ʵ������ | ���� |
����a����Բ����ƿ�е�������Ũ���Ȼ��رջ���a����ȼ�ƾ��� | Dװ���У���Һ��� Eװ���У�ˮ����Һ��ƣ���CCl4�������Ա仯 | Cl2��Br2��Fe3������������ǿ������˳��Ϊ________ |
��6����æ�ڹ۲�ͼ�¼��û�м�ʱֹͣ��Ӧ��D��E�о��������µı仯��
Dװ���У���ɫ������ȥ��
Eװ���У�CCl4��������ɫ��Ϊ��ɫ������ɫ���ֱ����ɺ�ɫ��
Ϊ̽������ʵ������ı��ʣ�С��ͬѧ����������£�
��.(SCN)2������±�ص������ơ������ԣ�Cl2>(SCN)2��
��.Cl2��Br2��Ӧ����BrCl�����ʺ�ɫ(�Դ���ɫ)���е�Լ5 �棬��ˮ����ˮ�ⷴӦ��
��.AgClO��AgBrO��������ˮ��
��.(SCN)2������±�ص������ơ������ԣ�Cl2>(SCN)2��
��.Cl2��Br2��Ӧ����BrCl�����ʺ�ɫ(�Դ���ɫ)���е�Լ5 �棬��ˮ����ˮ�ⷴӦ��
��.AgClO��AgBrO��������ˮ��
������ƽ���ƶ�ԭ��(��ϻ�ѧ����)����Cl2����ʱD����Һ��ɫ��ȥ��ԭ��________________________������Ƽ�ʵ��֤���������ͣ�ȡ������ɫ�����Һ���μ�_____________����______________�����������ͺ�����
����̽��E����ɫ�仯��ԭ�����ʵ�����£��÷�Һ©�������E���²���Һ�������ռ���ɫ���ʣ�ȡ����������AgNO3��Һ������۲쵽���а�ɫ�������������ϻ�ѧ������ͽ�������ɫ������ԭ��_________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com